
| 物質 | 顏色 | 水中溶解性 |
| Fe2S3 | 黑色 | 難溶于水 |
| FeS | 黑褐色 | 難溶于水 |
| 實驗步驟 | 操作 | 現象 | 備注 |
| 1 | 向2mL 0.1mol/L氯化鐵溶液中逐滴滴入3滴0.1mol/L 硫化鈉溶液 | 產生黑色沉淀,立即變為黃色沉淀,未見其它明顯現象 | 自始至終都未見紅褐色沉淀 |
| 2 | 繼續滴加3滴0.1mol/L 硫化鈉溶液 | 同上 | |
| 3 | 繼續滴加0.1mol/L 硫化鈉溶液至過量 | 產生黑色沉淀,振蕩后靜置,未發現明顯變化 |
| 實驗步驟 | 操作 | 現象 |
| 4 | 向2mL 0.1mol/L硫化鈉溶液中逐滴滴入3滴0.1mol/L 氯化鐵溶液 | 產生黑色沉淀,未見其它明顯現象 |
| 5 | 繼續滴加3滴0.1mol/L 氯化鐵溶液 | 同上 |
| 6 | 繼續滴加0.1mol/L 氯化鐵溶液至過量 | 同上 |
分析 (1)Fe3+與 S2-發生復分解反應生成Fe2S3;
(2)根據Fe3+中Fe元素處于高價,具有強氧化性,S2-中S元素處于低價,具有強還原性,可發生氧化還原反應判斷;
(3)步驟1向2mL 0.1mol/L氯化鐵溶液中逐滴滴入3滴0.1mol/L 硫化鈉溶液,氯化鐵溶液過量,產生黑色沉淀即為Fe2S3,立即變為黃色沉淀即S,說明Fe2S3被過量的氯化鐵溶液氧化成硫單質;
(4)步驟4向2mL 0.1mol/L硫化鈉溶液中逐滴滴入3滴0.1mol/L 氯化鐵溶液,氯化鐵溶液少量,不能將Fe2S3氧化成硫單質,而且體系中S2-不能還原Fe2S3生成S;
(5)步驟3向2mL 0.1mol/L氯化鐵溶液中逐滴滴入0.1mol/L 硫化鈉溶液至過量,產生黑色沉淀不再轉化為黃色硫沉淀,說明由于反應進行,造成Fe3+濃度降低,不足以氧化Fe2S3,則生成的Fe2+可能直接與S2-生成FeS沉淀;
(6)綜合以上分析解答,可得出結論:Fe3+與 S2-發生復分解反應.
解答 解:(1)Fe3+與 S2-發生復分解反應生成Fe2S3,離子方程式為:2Fe3++3S2-=Fe2S3↓,故答案為:2Fe3++3S2-=Fe2S3↓;
(2)因為Fe3+中Fe元素處于高價,具有強氧化性,S2-中S元素處于低價,具有強還原性,可發生氧化還原反應,故答案為:氧化還原反應; Fe3+中Fe元素處于高價,可以降低,體現氧化性; S2-中S元素處于低價,可以升高,體現還原性,兩者有可能發生氧化還原反應;
(3)步驟1向2mL 0.1mol/L氯化鐵溶液中逐滴滴入3滴0.1mol/L 硫化鈉溶液,氯化鐵溶液過量,首先產生黑色沉淀即為Fe2S3,立即變為黃色沉淀即S,說明Fe2S3被過量的氯化鐵溶液氧化成硫單質,則黑色沉淀轉變為黃色沉淀的離子方程式為:Fe2S3+4Fe3+=3S↓+6Fe2+,故答案為:Fe2S3+4Fe3+=3S↓+6Fe2+;
(4)步驟4向2mL 0.1mol/L硫化鈉溶液中逐滴滴入3滴0.1mol/L 氯化鐵溶液,氯化鐵溶液少量,不能將Fe2S3氧化成硫單質,而且體系中S2-不能還原Fe2S3生成S,所以只產生黑色沉淀,未見其它明顯現象,則步驟4與步驟1現象不同的原因可能是Fe3+量不足,不能氧化Fe2S3,而且體系中S2-不能還原Fe2S3,所以不能生成S,故答案為:Fe3+量不足,不能氧化Fe2S3,而且體系中S2-不能還原Fe2S3,所以不能生成S;
(5)步驟3向2mL 0.1mol/L氯化鐵溶液中逐滴滴入0.1mol/L 硫化鈉溶液至過量,產生黑色沉淀不再轉化為黃色硫沉淀,說明由于反應進行,造成Fe3+濃度降低,不足以氧化Fe2S3,則開始Fe3+氧化Fe2S3生成的Fe2+可能直接與S2-生成FeS沉淀,所以步驟3中產生的黑色沉淀中可能有FeS,故答案為:合理,依據實驗現象,發現黑色沉淀不再轉化為黃色硫沉淀,說明由于反應進行,造成Fe3+濃度降低,不足以氧化Fe2S3,Fe2+可能直接與S2-生成FeS;
(6)綜合以上分析解答,可得出結論:Fe3+與 S2-發生復分解反應,故答案為:Fe3+與 S2-發生復分解反應.
點評 本題考查了Fe3+與 S2-之間的反應探究,題目難度中等,注意掌握實驗方案設計與評價的原則,試題培養了學生的分析能力及化學實驗能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
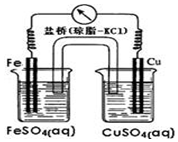
| A. | 銅作正極,發生氧化反應 | |
| B. | 外電路中電流方向為Fe→Cu | |
| C. | Fe電極的電極反應式為Fe-3e-=Fe3+ | |
| D. | 鹽橋將兩電解質溶液連接起來,傳導電流,通過等量的K+和Cl-的定向移動,使兩電解質溶液保持電中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
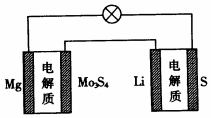 已知:鎂電池的總反應為xMg+Mo3S4$?_{放電}^{充電}$MgxMo3S4,鋰硫電池的總反應為2Li+S$?_{放電}^{充電}$Li2S.下列說法正確的是( )
已知:鎂電池的總反應為xMg+Mo3S4$?_{放電}^{充電}$MgxMo3S4,鋰硫電池的總反應為2Li+S$?_{放電}^{充電}$Li2S.下列說法正確的是( )| A. | 鎂電池放電時,Mg2+向負極遷移 | |
| B. | 鎂電池放電時,正極發生的電極反應為Mo3S4+2xe-=Mo3S42- | |
| C. | 理論上兩種電池的比能量相同(參與電極反應的單位質量的電極材料放出電能的大小稱為該電池的比能量) | |
| D. | 圖中Li作負極,Mo3S4作陽極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B. | C. | D. |
| 《神農本草經》記載,麻黃能“止咳逆上氣” | 胃舒平藥片 (復方氫氧化鋁)  |  |  秦朝彩俑 |
| 古代中國人已用麻黃治療咳嗽 | 該藥是抗酸藥,服用時喝些醋能提高藥效 | 看到有該標志的丟棄物,應遠離并報警 | 古代中國人掌握化學制顏料方法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2具有氧化性,可用于漂白紙漿 | |
| B. | NaHCO3能與堿反應,可用作焙制糕點的膨松劑 | |
| C. | 濃硫酸具有脫水性,可用于干燥氫氣 | |
| D. | MgO、Al2O3熔點高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com