
| 序號 | 滴定前讀數(mL) | 滴定后讀數(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
分析 ②KMnO4溶液具有強氧化性,應用酸式滴定管盛裝;高錳離子有催化作用而導致反應速率加快;乙二酸與KMnO4發生氧化還原反應,滴定終點時,溶液由無色變成紫紅色,且半分鐘內不褪色;
③第3組KMnO4溶液的體積與第1、2組相差比較大,舍去第3組,應按第1、2組的平均值為消耗KMnO4溶液的體積,根據關系式2KMnO4~5H2C2O4計算;
④根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差.
解答 解:②KMnO4溶液具有強氧化性,應用酸式滴定管盛裝;高錳酸根離子被還原生成的錳離子有催化作用而導致反應速率加快,所以剛滴下少量KMnO4溶液時,溶液迅速變成紫紅色;滴定終點時,當滴入最后一滴高錳酸鉀溶液,錐形瓶內的顏色由無色變成紫紅色,且半分鐘不變化,證明達到終點;
故答案為:酸式;反應中生成的錳離子具有催化作用,所以隨后褪色會加快;滴入最后一滴高錳酸鉀溶液,錐形瓶內的顏色由無色變成紫紅色,且半分鐘不變化;
③第3組KMnO4溶液的體積與第1、2組相差比較大,舍去第3組,應按第1、2組的平均值為消耗KMnO4溶液的體積,故消耗KMnO4溶液的體積為$\frac{20.10+19.90}{2}$mL=20mL
設樣品的純度為x,
5H2C2O4 +2MnO4-+6H+=10CO2↑+2Mn2++8H2O
450g 2mol
5.0g×x×$\frac{1}{10}$g (0.1000×0.020)mol
解得:x=$\frac{0.1×0.020×450}{2×5.0×0.1}$=90.00%,
故答案為:20.00;90.00%;
④A.未用標準濃度的酸性KMnO4溶液潤洗滴定管,標準液的濃度偏小,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(標準)偏大,故A正確;
B.滴定前錐形瓶有少量水,待測液的物質的量不變,對V(標準)無影響,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(標準)不變,故B錯誤;
C.滴定前滴定管尖嘴部分有氣泡,滴定后氣泡消失,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(標準)偏大,故C正確;
D.不小心將少量酸性KMnO4溶液滴在錐形瓶外,造成V(標準)偏大,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(標準)偏大,故D正確;
E.觀察讀數時,滴定前仰視,滴定后俯視,造成V(標準)偏小,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$分析,c(標準)偏小,故E錯誤;
故選ACD.
點評 本題主要考查了中和滴定操作、誤差分析以及計算,難度不大,根據課本知識即可完成.


科目:高中化學 來源: 題型:解答題
 某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:
某實驗小組設計用50mL 1.0mol/L鹽酸跟50mL 1.1mol/L氫氧化鈉溶液在上圖裝置中進行中和反應.在大燒杯底部墊泡沫塑料(或紙條),使放入的小燒杯杯口與大燒杯杯口相平.然后再在大、小燒杯之間填滿碎泡沫塑料(或紙條),大燒杯上用泡沫塑料板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過.通過測定反應過程中所放出的熱量可計算中和熱.試回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | 溫差(t2-t1)/℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
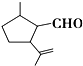 有機物A是一種重要的化工原料,其結構簡式如圖,下列檢驗A中官能團的試劑和順序正確的是( )
有機物A是一種重要的化工原料,其結構簡式如圖,下列檢驗A中官能團的試劑和順序正確的是( )| A. | 先加KMnO4酸性溶液,再加銀氨溶液,微熱 | |
| B. | 先加溴水,再加KMnO4酸性溶液 | |
| C. | 先加銀氨溶液,微熱,再加溴水 | |
| D. | 先加入足量的新制Cu(OH)2懸濁液,微熱,酸化后再加溴水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2項 | B. | 3項 | C. | 4項 | D. | 5項 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  制備 Fe(OH)2 并能較 長時間觀察其顏色 | |
| B. |  探究溫度對平衡移動的影響 | |
| C. |  驗證鐵發生析氫腐蝕 | |
| D. | 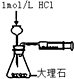 測定反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com