
【題目】有機物X 是某種藥物的主要成分,工業(yè)上合成該化合物的一種路線如下(部分反應物、反應條件略去):

已知:酯與含羥基的化合物可發(fā)生如下酯交換反應:![]() (其中R、
(其中R、![]() 、
、![]() 均代表烴基)
均代表烴基)
(1)反應①所需反應條件是_______________,反應②的反應類型是________________。
(2)E中官能團的名稱是_____________; 反應④的產物除了X以外。另一種產物的名稱是_________。
(3)D在一定條件下能發(fā)生縮聚反應生成高分子化合物,該高分子化合物的結構簡式為_____________。
(4)反應③的化學方程式為_____________________________。
(5)D的同分異構體有多種,寫出符合下列條件的有機物結構簡式____________。
Ⅰ.苯環(huán)上一氯代物只有一種
Ⅱ.與氯化鐵溶液發(fā)生顯色反應
Ⅲ.能與新制Cu(OH)2懸濁液共熱產生紅色沉淀
Ⅳ.1mol該物質與足量的鈉充分反應產生標準狀況下22.4LH2
(6)已知:
①![]() ;
;
②當苯環(huán)上已有一個“-CH3”或“-Cl”時,新引入的取代基一般在它的鄰位或對位;當苯環(huán)上已有一個“-NO2”或“-COOH”時,新引入的取代基一般在它的間位。
請寫出以甲苯、乙醇為原料制備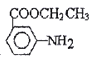 的合成路線圖(無機試劑任用)___________。
的合成路線圖(無機試劑任用)___________。
【答案】 濃硫酸,(水浴)加熱 還原反應 羥基、醚鍵 “甲醇”、“木精”或者“木醇” 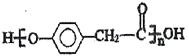
![]()
 或
或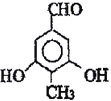
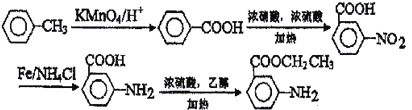
【解析】A與濃硫酸、濃硝酸的混合溶液加熱發(fā)生硝化反應生成B,B中的硝基發(fā)生還原反應生成C;D分子中含有羧基,與甲醇發(fā)生酯化反應生成E;根據X的分子式可判斷E與F發(fā)生的是酯基的交換反應生成X和甲醇,則X的結構簡式為![]() 。
。
(1)A與濃硫酸、濃硝酸的混合溶液加熱發(fā)生硝化反應生成B。反應②的反應類型是還原反應,故答案為:濃硫酸,(水浴)加熱;還原反應;
(2)E(![]() )中官能團有羥基、醚鍵;根據X的分子式可判斷反應④中E與F發(fā)生的是酯基的交換反應生成X和甲醇,故答案為:羥基、醚鍵;甲醇;
)中官能團有羥基、醚鍵;根據X的分子式可判斷反應④中E與F發(fā)生的是酯基的交換反應生成X和甲醇,故答案為:羥基、醚鍵;甲醇;
(3)D在一定條件下能發(fā)生縮聚反應生成高分子化合物,該高分子化合物的結構簡式為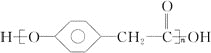 。
。
(4)反應③是D與甲醇發(fā)生的酯化反應,反應的化學方程式為![]() +CH3OH
+CH3OH![]()
![]() +H2O,故答案為:
+H2O,故答案為:![]() +CH3OH
+CH3OH![]()
![]() +H2O;
+H2O;
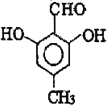
(5) D為![]() ,Ⅰ.苯環(huán)上一氯代物只有一種;Ⅱ.與氯化鐵溶液發(fā)生顯色反應,說明含有酚羥基;Ⅲ.能與新制Cu(OH)2懸濁液共熱產生紅色沉淀,說明含有醛基;Ⅳ.1mol 該物質與足量的鈉充分反應產生標準狀況下22.4LH2即1mol氫氣,說明結構中含有2個羥基;滿足條件的有
,Ⅰ.苯環(huán)上一氯代物只有一種;Ⅱ.與氯化鐵溶液發(fā)生顯色反應,說明含有酚羥基;Ⅲ.能與新制Cu(OH)2懸濁液共熱產生紅色沉淀,說明含有醛基;Ⅳ.1mol 該物質與足量的鈉充分反應產生標準狀況下22.4LH2即1mol氫氣,說明結構中含有2個羥基;滿足條件的有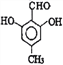 或
或 ,故答案為:
,故答案為: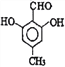 或
或 ;
;
(6) 以甲苯、乙醇為原料制備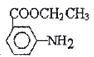 。要合成間-氨基苯甲酸乙酯,則首先要利用甲苯的氧化反應生成苯甲酸,然后利用苯甲酸的取代反應引入硝基,再把硝基還原為氨基,最后與乙醇發(fā)生酯化反應即可,合成路線可設計為:
。要合成間-氨基苯甲酸乙酯,則首先要利用甲苯的氧化反應生成苯甲酸,然后利用苯甲酸的取代反應引入硝基,再把硝基還原為氨基,最后與乙醇發(fā)生酯化反應即可,合成路線可設計為:![]()
![]()
![]()
![]()
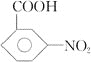
![]()
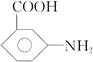
![]()
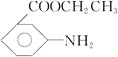 ,故答案為:
,故答案為:![]()
![]()
![]()
![]()

![]()

![]()
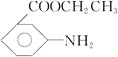 。
。


科目:高中化學 來源: 題型:
【題目】下列有關化學反應速率的說法正確的是
A. 升高溫度,可以加快反應速率,縮短可逆反應達到平衡的時間
B. 化學反應達到最大限度時,正逆反應速率也達到最大且相等
C. 增加固體反應物的量可以加快反應速率
D. 用鐵片和稀硫酸反應制H2比用的濃硫酸產生H2的速率慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 10mL0.1mol·L-1醋酸中加入幾滴1mol·L-1H2SO4后,c(CH3COOH)/c(H+)增大
B. 常溫下pH=2的H2SO4與pH=13的NaOH溶液混合,所得混合液的pH=11,則H2SO4溶液與NaOH溶液的體積比9:1
C. 90℃時,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合,溶液顯中性
D. 0.5mol·L-1的下列溶液①NH3·H2O ②NH4Cl ③NH4HCO3 ④(NH4)2SO4,NH4+物質的量濃度大小關系:④>①>②>③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家設計了一種雙室微生物燃料電池,以苯酚(C6H6O)為燃料,同時可除去酸性廢水中的硝酸鹽。下列說法正確的是
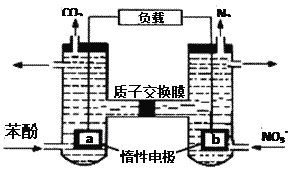
A. a極的電極反應式為C6H6O+11H2O + 28e-=6CO2↑ + 28H+
B. 外電路電子移動方向由b極到a極
C. 若正極產生5.6L氣體(標況下),則轉移電子2.5mol
D. 電池工作一段時間后,左池溶液的pH增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖1是細胞中3種化合物含量的扇形圖,圖2是有活性的細胞中元素含量的柱形圖,下列說法不正確的是

A. 若圖1表示正常細胞,則元素中含量最多的是圖2中的a
B. 若圖1表示細胞完全脫水后化合物含量的扇形圖,則A為蛋白質
C. 圖2中數(shù)量最多的元素是碳元素,這與細胞中含量最多的化合物有關
D. 若圖1表示正常細胞,則B化合物具有多樣性,其必含的元素為C,H,O,N
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有六種短周期元素,已知A的單質是最清潔的能源物質,其他元素的原子半徑及主要化合價如下表:
元素代號 | B | C | D | E | F |
原子半徑/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合價 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根據上述信息回答以下問題。
(1)D在元素周期表中的位置______________;E的離子結構示意圖______________。
(2)關于A元素在周期表中的位置,一直存在紛爭,有人主張把它放在第ⅦA族,試分析其理由________________________________。
(3)用電子式表示B的單質與D的單質形成化合物的過程________________________。
(4)下列各項比較,正確的是________________________。
①氫化物的沸點:D低于F ②A~F元素的簡單離子半徑:C的最大
③氣態(tài)氫化物穩(wěn)定性:D比E穩(wěn)定 ④最高價氧化物對應的水化物堿性:B小于C
(5)E單質常用于自來水消毒。用必要的文字和離子方程式解釋原因______________________________________________________________。
(6)寫出C的單質與B的最高價氧化物的水化物反應的離子方程式________________。
(7)C的單質與元素M的紅棕色氧化物N反應可用于焊接鋼軌,該反應的化學方程式為________________________________。
(8)已知單質M的燃燒熱為375kJ/mol,寫出表示其燃燒熱的熱化學方程式___________________________。
(9)已知NH3結合質子的能力強于F的氫化物,請用最恰當?shù)碾x子方程式證明這個結論________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相對分子質量為M的氣態(tài)化合物VL(標準狀況)溶于mg水中,得到溶液的質量分數(shù)為ω%,物質的量濃度cmol/L,密度為ρg/cm3,則下列說法正確的是
A. 相對分子質量M可表示為:![]()
B. 溶液密度ρ可表示為:![]()
C. 溶液的質量分數(shù)ω%可表示為:![]()
D. 物質的量濃度C可表示為:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬晶體的說法中,正確的是( )
A. 簡單立方堆積的晶胞中原子配位數(shù)是8
B. 晶胞中配位數(shù)為12的金屬,一定是面心立方最密堆積
C. Zn的晶胞類型與銅相同
D. 鐵的晶胞中空間利用率為68%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各圖是實驗室制取和收集氣體的常用裝置:
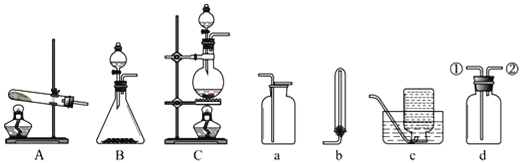
(1)用A裝置制取氨氣的化學方程式是___________________________________。若用B裝置制取氨氣,則選用的藥品是________________________________。
(2)收集干燥氨氣時,選用的干燥劑是___________________________________。
(3)圖a、b、c、d是某學生設計的收集氣體的幾種裝置.若用d裝置收集氨氣,則氣體流向為___________(用序號說明).若要收集NO氣體,則應選擇______裝置;
(4)若用C裝置與d裝置相連制取并收集X氣體,則X可能是下列氣體中的_____。
①CO2 ②NO ③Cl2 ④SO2 ⑤NH3
(5)按圖裝置進行NH3性質實驗。
①先打開旋塞1,B瓶中的現(xiàn)象是_______________________,穩(wěn)定后,關閉旋塞1。
②再打開旋塞2,B瓶中的現(xiàn)象是___________________________________________。
 。
。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com