
【題目】相對分子質量為M的氣態化合物VL(標準狀況)溶于mg水中,得到溶液的質量分數為ω%,物質的量濃度cmol/L,密度為ρg/cm3,則下列說法正確的是
A. 相對分子質量M可表示為:![]()
B. 溶液密度ρ可表示為:![]()
C. 溶液的質量分數ω%可表示為:![]()
D. 物質的量濃度C可表示為:![]()
科目:高中化學 來源: 題型:
【題目】實施以節約能源和減少廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求。試運用所學知識,回答下列問題:
(1)已知某溫度下某反應的化學平衡常數表達式為:K=c(H2O)/[ c(CO)·c(H2)]所對應的化學反應方程式為:________________________。
(2)已知在一定溫度下,①C(s)+CO2(g)![]() 2CO(g) △H1=a kJ/mol 平衡常數K1;
2CO(g) △H1=a kJ/mol 平衡常數K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常數K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常數K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) △H3 平衡常數K3。
CO(g)+H2(g) △H3 平衡常數K3。
則K1、K2、K3之間的關系是:_____________,△H3=__________(用含a、b的代數式表示)。
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,發生如下反應:CO(g)+H2O(g)![]() H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
溫度/℃ | 400 | 500 | 800 |
平衡常數K | 9.94 | 9 | 1 |
該反應的正反應方向是_________反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的起始濃度均為0.020 mol·L-1,在該條件下,CO的平衡轉化率為:______________。
(4)在催化劑存在條件下反應:H2O(g)+CO(g)![]() CO2(g)+H2(g),CO轉化率隨蒸氣添加量的壓強比及溫度變化關系如下左圖所示;
CO2(g)+H2(g),CO轉化率隨蒸氣添加量的壓強比及溫度變化關系如下左圖所示;

對于氣相反應,用某組分(B)的平衡分壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作KP),則該反應的KP的表達式:KP=____________,提高p[H2O(g)]/p(CO)比,則KP__________(填“變大”、“變小”或“不變”)。實際上,在使用鐵鎂催化劑的工業流程中,一般采用400℃左右、p[H2O(g)]/p(CO)=3~5。其原因可能是_________________________________。
(5)工業上可利用原電池原理除去工業尾氣中的CO并利用其電能,反應裝置如上右圖所示,請寫出負極的電極反應式:___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知常溫下CH3COOH的電離常數K=1.6×10-5,1g4=0.6。該溫度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH變化曲線如圖所示(忽略溫度變化)。下列說法正確的是
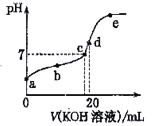
A. 滴定過程中宜選用甲基橙作指示劑
B. a點溶液中c(H+)為1×10-4 mol·L-1
C. a、b、c、d、e四點中水的電離程度最大的是e點
D. d 點時溶質的水解常數為6.25×10-10
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物X 是某種藥物的主要成分,工業上合成該化合物的一種路線如下(部分反應物、反應條件略去):

已知:酯與含羥基的化合物可發生如下酯交換反應:![]() (其中R、
(其中R、![]() 、
、![]() 均代表烴基)
均代表烴基)
(1)反應①所需反應條件是_______________,反應②的反應類型是________________。
(2)E中官能團的名稱是_____________; 反應④的產物除了X以外。另一種產物的名稱是_________。
(3)D在一定條件下能發生縮聚反應生成高分子化合物,該高分子化合物的結構簡式為_____________。
(4)反應③的化學方程式為_____________________________。
(5)D的同分異構體有多種,寫出符合下列條件的有機物結構簡式____________。
Ⅰ.苯環上一氯代物只有一種
Ⅱ.與氯化鐵溶液發生顯色反應
Ⅲ.能與新制Cu(OH)2懸濁液共熱產生紅色沉淀
Ⅳ.1mol該物質與足量的鈉充分反應產生標準狀況下22.4LH2
(6)已知:
①![]() ;
;
②當苯環上已有一個“-CH3”或“-Cl”時,新引入的取代基一般在它的鄰位或對位;當苯環上已有一個“-NO2”或“-COOH”時,新引入的取代基一般在它的間位。
請寫出以甲苯、乙醇為原料制備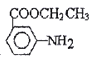 的合成路線圖(無機試劑任用)___________。
的合成路線圖(無機試劑任用)___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.氧化還原反應中有一種元素被氧化時,一定有另一種元素被還原
B.含有最低價元素的化合物不一定具有很強的還原性
C.陽離子只能得電子被還原,陰離子只能失電子被氧化
D.在化學反應中,得電子越多的氧化劑,其氧化性就越強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液中,可大量共存的離子組是
A.Cu2+、NO3-、Cl-、SO42-B.H+、Cl-、K+、CO32-
C.Na+、HCO3-、SO42-、Cl-D.K+、Mg2+、SO42-、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
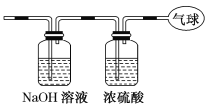
【題目】現有14.4 g CO和CO2的混合氣體,在標準狀況下所占的體積約為8.96 L。回答下列問題:
(1)混合氣體中碳原子的個數________。(用NA表示阿伏加德羅常數的值)
(2)該混合氣體的平均摩爾質量________g/mol。
(3)將混合氣體依次通過如圖裝置,最后收集在氣球中。氣球中收集到的氣體是________,標準狀況下氣球中收集到的氣體的體積為________L,如果上述裝置中使用的濃硫酸失效,則氣球中氣體的相對分子質量會________(填“變大”、“變小”或“不受影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是
A. 明礬能水解生成Al(OH)3膠體,可用作凈水劑
B. 除去MgCl2酸性溶液中的Fe3+,可加入MgCO3固體
C. SO2具有氧化性,可用于漂白紙漿
D. Zn具有還原性和導電性,可用作鋅錳干電池的負極材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 某溫度下純水pH=6,則在該條件下pH=4的醋酸和pH=10的NaOH中水的電離程度相同
B. NH4Cl溶于D2O的離子方程式:NH![]() +D2O
+D2O![]() NH3·D2O+H+
NH3·D2O+H+
C. 已知S的燃燒熱為Q kJ·mol-1,則S(s)+![]() O2(g)===SO3(g) ΔH=-Q kJ·mol-1
O2(g)===SO3(g) ΔH=-Q kJ·mol-1
D. 水的自偶電離方程式:2H2O![]() H3O++OH-,則液氨自偶電離方程式:2NH3
H3O++OH-,則液氨自偶電離方程式:2NH3![]() NH
NH![]() +NH
+NH![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com