
【題目】G是某抗炎癥藥物的中間體,其合成路線如下:
已知:①![]()
![]()
② ![]()
![]()
![]() (呈堿性,易氧化)
(呈堿性,易氧化)
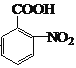
(1)C的官能團名稱是_______________;
(2)反應①的反應類型為___________;反應②的作用是___________________;
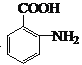
(3)下列對有機物G的性質推測不正確的是____________________ (填選項字母);
A.1molG與足量NaHCO3溶液反應放出2molCO2
B.能發生取代反應和氧化反應
C.能加聚合成高分子化合物
D.具有兩性,既能與酸反應也能與堿反應
(4)寫出E→F的化學反應方程式______________________________;
(5)同時符合下列條件的D的同分異構體有__________種:
①含有苯環且能發生水解反應:②能發生銀鏡反應;③能與NaHCO3溶液反應放出CO2。
(6)已知:苯環上有烷烴基時,新引入的取代基連在苯環的鄰、對位:苯環上有發基時,新引入的取代基連在苯環的問位。根據題中的信息,寫出以甲苯為原料合成有機物的流程圖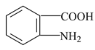 (無機試劑任選)_______________________________________________________________________________________。 合成路線流程圖示例:X
(無機試劑任選)_______________________________________________________________________________________。 合成路線流程圖示例:X![]() Y
Y![]() Z……目標產物
Z……目標產物
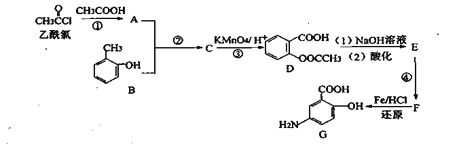
【答案】酯基 取代反應 保護酚羥基,以防被氧化 AC ![]() +HNO3
+HNO3![]()
![]() +H2O 17
+H2O 17 ![]()
![]()
![]()
![]()
【解析】
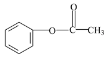
乙酰氯和乙酸反應生成A,A和B反應生成C,C被酸性高錳酸鉀溶液氧化生成D,根據D結構簡式知,C為![]() ,A為(CH3CO)2O,D發生水解反應然后酸化得到E,E為
,A為(CH3CO)2O,D發生水解反應然后酸化得到E,E為![]() ,E反應生成F,F發生還原反應生成G,根據G結構簡式結合題給信息知,F為
,E反應生成F,F發生還原反應生成G,根據G結構簡式結合題給信息知,F為![]() ;
;
(6)甲苯和濃硝酸發生取代反應生成鄰硝基甲苯,鄰硝基甲苯被酸性高錳酸鉀溶液氧化生成鄰硝基苯甲酸,鄰硝基苯甲酸被還原生成鄰氨基苯甲酸,據此分析解答。
(1)根據分析,C為![]() ,則C的官能團名稱是酯基;
,則C的官能團名稱是酯基;
(2)反應①為乙酰氯和乙酸反應生成A,A為(CH3CO)2O,乙酰氯中的氯原子被取代,則反應類型為取代反應;反應②的作用是保護酚羥基,防止被氧化;
(3) A.G中只有羧基能和碳酸氫鈉反應生成二氧化碳,所以1molG與足量NaHCO3溶液反應放出1molCO2,故A錯誤;
B.G中含有酚羥基,能發生氧化反應,不能發生消去反應,羧基能發生取代反應,故B正確;
C.G中含有羧基和酚羥基,所以能發生縮聚反應生成高分子化合物,故C錯誤;
D.G中含有羧基和氨基,所以具有酸性和堿性,則具有兩性,既能與酸反應也能和堿反應,故D正確;
答案選AC;
(4) E為![]() ,F為
,F為![]() ,E在濃硫酸加熱條件下與硝酸反應取代反應,化學反應方程式
,E在濃硫酸加熱條件下與硝酸反應取代反應,化學反應方程式![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(5)①含有苯環且能發生水解反應,說明結構中含有苯環和酯基,②能發生銀鏡反應,說明結構中含有醛基,③能與NaHCO3溶液反應放出CO2,說明結構中含有羧基,由以上綜合分析,該有機物的結構可以由![]() 與-CH2OOCH構成,共有鄰間對3種結構,或由
與-CH2OOCH構成,共有鄰間對3種結構,或由![]() 與-CH3、-OOCH構成,共有10種結構,或由
與-CH3、-OOCH構成,共有10種結構,或由![]() 和-OOCH構成有鄰間對3中結構,或
和-OOCH構成有鄰間對3中結構,或![]() 和
和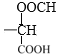 構成,只有一種結構,則同時符合下列條件的D的同分異構體有17種;
構成,只有一種結構,則同時符合下列條件的D的同分異構體有17種;
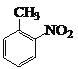
(6)甲苯和濃硝酸發生取代反應生成鄰硝基甲苯,鄰硝基甲苯被酸性高錳酸鉀溶液氧化生成鄰硝基苯甲酸,鄰硝基苯甲酸被還原生成鄰氨基苯甲酸,其合成流程圖為: ![]()
![]()

![]()

![]()
 。
。


科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀鹽酸,CO2的生成量與加入鹽酸的體積(V)的關系如圖所示。下列判斷正確的是( )

A.在0~a范圍內,只發生中和反應
B.a=0.3
C.ab段發生反應的離子方程式為CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH與Na2CO3的物質的量之比為1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①石墨 ②燒堿 ③石灰水 ④氯化鈉晶體 ⑤鹽酸 ⑥氨氣 ⑦蔗糖 ⑧氯氣 ⑨液態氯化氫 ⑩硫酸溶液上述物質中能導電的是______,屬于電解質的是_______,屬于非電解質的是________。(填編號)
(2)按要求寫出下列方程式:
①小蘇打治療胃酸過多的離子方程式:____________________。
②向氫氧化鈉溶液中加入的鋁片離子方程式:__________________。
(3)按要求進行化學計算:
①0.5mol某固體A的質量是40 g,A的相對分子質量為__________________。
②在同溫同壓同體積的條件下,H2與氣體A的質量之比是1∶8,則A的摩爾質量為_____________。
③2KMnO4+16HCl(濃) =2KCl+2MnCl2+5Cl2↑+8H2O,該反應氧化劑與還原劑的物質的量之比為________。
④98%的濃H2SO4(ρ=1.84 g/cm3)物質的量濃度為__________。
⑤相同物質的量濃度的NaCl、MgCl2、AlCl3溶液,分別與足量的AgNO3溶液反應,當生成的AgCl質量相同時,消耗的三種溶液的體積比為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用固體表面催化工藝進行NO分解的過程如下圖所示。下列說法不正確的是

A.該分解過程是:2NO![]() N2+O2
N2+O2
B.實驗室制取NO可以用銅與稀硝酸反應
C.過程②釋放能量,過程③吸收能量
D.標準狀況下,NO分解生成5.6 LN2轉移電子數約為6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤煙氣中含有大量NOx和SO2,可經處理消除。
(1)用CH4催化還原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反應CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若該反應中將NOx還原為N2,消耗標準狀況下5.6L CH4,則反應過程中轉移的電子物質的量為___;
(2)用CH4原NO2的反應為CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向兩個容積均為2L溫度分別為T1°C、T2°C的恒溫恒容密閉容器中分別加入物質的量為1 mol的CH4和2molNO2,測得各容器中n(NO2)隨反應時間t的變化如圖所示:

①T1_______T2(填“>”或“<”);
②T1°C時,40~80 min,用N2的濃度變化表示的平均反應速率為v(N2)=_____,此溫度下的化學平衡常數K=______;
③T1°C下,200 min時,向容器中再加入CH4、NO2和H2O(g)各l mol,化學平衡_____移動(填“正向”、 “逆向”或“不”);
(3)亞氯酸鈉(NaClO2)和次氯酸鈉(NaClO)堿性混合液作為復合吸收劑可脫除煙氣中的NOx、SO2,使其轉化為NO3-、SO42-。
①寫出NO與NaClO2反應的離子方程式:__________________________;
②下圖表示在一定條件下溫度與復合吸收劑對煙氣中SO2、NO脫除效率的關系。圖中SO2比NO脫除效率高的原因可能是____________________________ ( 答出一點即可);

(4)用堿液脫硝是目前研究的課題之一。
①將NO、NO2 控制物質的量之比接近1:1通入足量氫氧化鈉溶液可制NaNO2溶液。請寫出該反應的離子方程式______________________________。
②將工業上氫氧化鈉溶液脫硝得到的NaNO2、NaNO3的混合液和NaOH溶液分別加到下圖所示的電解槽中進行電解。寫出A室NO2發生的電極反應:____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式中,正確的是
A.甲烷的燃燒熱為890.3kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,將0.5molN2(g)和1.5molH2(g)置于密閉容器中充分反應生成NH3(g)放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反應的中和熱△H=-57.3kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ·mol-1
D.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇燃料電池能量轉化率高、對環境無污染,可作為常規能源的替代品而越來越受到關注,其工作示意圖如圖,其總反應為:2CH3OH+3O2=2CO2+4H2O。下列說法不正確的是

A. 電極A是負極,發生氧化反應
B. 電池工作時,電解液中的H+通過質子交換膜向B電極遷移
C. 放電前后電解質溶液的pH不變
D. b物質在電極上發生的電極反應式為:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是巨大的資源寶庫,從海水中提取食鹽和溴的過程如下:
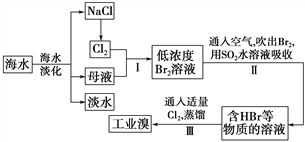
(1)請列舉海水淡化的兩種方法:________、________。
(2)步驟Ⅰ中已獲得Br2,步驟Ⅱ中又將Br2還原為Br-,其目的是_________。
(3)步驟Ⅱ用SO2水溶液吸收Br2,吸收率可達95%,有關反應的離子方程式為_______,由此反應可知,除環境保護外,在工業生產中應解決的主要問題是_______。
(4)某化學研究性學習小組為了了解從工業溴中提純溴的方法,查閱了有關資料知:Br2的沸點為59 ℃,微溶于水,有毒并有強腐蝕性。他們參觀生產過程后,畫了如下裝置簡圖:
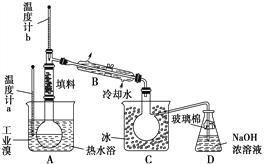
請你參與分析討論:
①圖中儀器B的名稱是____________。
②整套實驗裝置中儀器連接均不能用橡膠塞和橡膠管,其原因是__________。
③實驗裝置氣密性良好,要達到提純溴的目的,操作中如何控制關鍵條件?___________。
④C中液體顏色為________________。為除去該產物中仍殘留的少量Cl2,可向其中加入NaBr溶液,充分反應后,再進行的分離操作是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可由氫氣、氮氣合成氨氣,溶于水形成氨水。一定溫度下,向2L固定體積的密閉容器中加入N2(g)和H2(g),發生反應:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物質的量隨時間的變化如圖所示。
2NH3(g)+Q(Q>0),NH3物質的量隨時間的變化如圖所示。
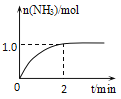
(1)0~2min內的平均反應速率v(H2)=___。
(2)該溫度下,反應的平衡常數表達式K=___。
其平衡常數K與溫度T的關系如下表:
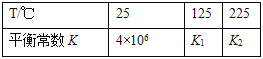
試判斷K1___K2(填寫“>”、“=”或“<”)。
(3)能說明該合成氨反應已達到平衡狀態的是___(選填編號)。
a.3v(N2)=v(H2)
b.容器內壓強保持不變
c.混合氣體的密度保持不變
d.25℃時,測得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH如表。
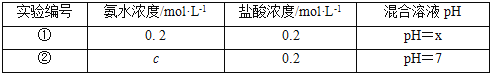
請回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各離子濃度大小關系為___。
(5)請你設計一個能證明一水合氨是弱電解質的簡要方案___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com