
| 化學方程式 | K (t1) | K (t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
 .
.分析 (1)溫度升高,平衡常數減小,說明平衡向逆反應方向移動,HX的生成反應為放熱反應;
(2)HX中H與X以一對共用電子對結合,電子式為:
(3)F、Cl、Br、I的得電子能力依次減小,故HX共價鍵的極性由強到弱的順序是HF、HCl、HBr、HI;
(4)K值越大,說明反應的正向程度越大,即轉化率越高,反應的正向程度越小,說明生成物越不穩定,越易分解.
解答 解:(1)由表中數據可知,溫度越高平衡常數越小,這說明升高溫度平衡向逆反應方向移動,所以HX的生成反應是發熱反應;
故答案為:放熱;
(2)HX屬于共價化合物,H-X之間形成的化學鍵是極性共價鍵,因此HX的電子式是 ,故答案為:
,故答案為: ;
;
(3)F、Cl、Br、I屬于ⅦA,同主族元素自上而下隨著核電荷數的增大,原子核外電子層數逐漸增多,導致原子半徑逐漸增大,因此原子核對最外層電子的吸引力逐漸減弱,從而導致非金屬性逐漸減弱,即這四種元素得到電子的能力逐漸減弱,所以H-F鍵的極性最強,H-I的極性最弱,因此HX共價鍵的極性由強到弱的順序是HF、HCl、HBr、HI,故答案為:HF>HCl>HBr>HI;
(4)K值越大,說明反應的正向程度越大,即轉化率越高,a正確;反應的正向程度越小,說明生成物越不穩定,越易分解,因此選項d正確;而選項b、c與K的大小無直接聯系.
故答案為:ad.
點評 用圖表表述化學過程或呈現背景信息是化學常用的表達方式,全面考查學生分析、比較、概括、歸納問題的能力.


科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Ba2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Ca2+、NH4+、NO3-、Cl- | D. | K+、Na+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
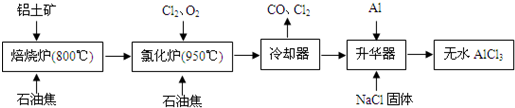
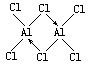 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.6 mol | B. | 1.2 mol | C. | 2.4 mol | D. | 1.8 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K能從LiCl的溶液中置換出Li | |
| B. | 隨著原子序數的遞增,單質與水反應的劇烈程度減弱 | |
| C. | 隨著原子序數的遞增,單質熔點逐漸降低 | |
| D. | Cs2CO3受熱易分解 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高溫下,0.2molFe與足量稀硫酸反應反應,生成的H2分子數目為0.3NA | |
| B. | 2 L0.5 mol×L-1硫酸鉀溶液中陰離子所帶電荷數為NA | |
| C. | C2H4和N2組成的42g混合氣體中原子的個數為3NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反應中,生成28gN2 時,轉移的電子數目為3.75NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數是6 | B. | 質量數是6 | C. | 電子數是13 | D. | 中子數是13 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com