
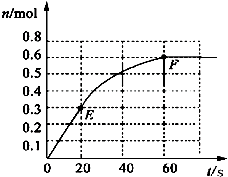
 373K時,某1L密閉容器中加入1mol NH3發生如下可逆反應:2NH3(g)?N2(g)+3H2(g).其中物質H2的物質的量變化如圖所示.
373K時,某1L密閉容器中加入1mol NH3發生如下可逆反應:2NH3(g)?N2(g)+3H2(g).其中物質H2的物質的量變化如圖所示.分析 (1)依據圖象分析60s達到平衡,B的物質的量變化為0.6mol,計算得到B的反應速率,結合實驗速率之比等于化學方程式計量數之比計算得到A的反應速率;
(2)依據平衡常數的概念是用生成物平衡濃度的冪次方乘積除以反應物平衡濃度的冪次方乘積得到;
(3)增大物質濃度,反應速率增大,加入A相當于增大體系壓強,增大壓強,平衡逆向進行,氨氣轉化率減小;氨氣平衡濃度增大;
(4)溫度升高,B的濃度增大,反應正向進行,反應是吸熱反應,平衡常數隨溫度變化.
解答 解:(1)前 20 s氫氣的物質的量變化量為0.3mol,則氨氣的變化量為:0.2mol,20 s內NH3(g)的平均反應速率為v=$\frac{\frac{0.2mol}{1L}}{20s}$=0.01mol/(L•s),故答案為:0.01mol/(L•s);
(2)2NH3(g)?N2(g)+3H2(g)
初起:1mol 0 0
變化:0.4mol 0.2mol 0.6mol
平衡:0.6mol 0.2mol 0.6mol
所以平衡常數K=$\frac{\frac{0.2}{1}×(\frac{0.6}{1})^{3}}{(\frac{0.6}{1})^{2}}$=0.12,故答案為:0.12;
(3)增大物質濃度,反應速率增大,加入氨氣相當于增大體系壓強,增大壓強,平衡逆向進行,氨氣轉化率減小,氨氣平衡濃度增大,故答案為:減小;增大;
(4)將原平衡升溫至 473K,重新達平衡時(其他條件不變),H2的平衡濃度為NH3的2倍,說明平衡向正反應方向移動,正反應是吸熱反應;為增大平衡體系中H2的物質的量,即使平衡正向移動,a.升高溫度 b.擴大容器的體積可以達到,故答案為:吸熱反應;ab.
點評 本題考查了化學平衡的移動原理應用,反應速率的影響因素分析,平衡常數的計算和影響因素,注意平衡常數隨溫度變化,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3溶于過量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化鐵溶液腐蝕印刷線路板上的銅:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向亞硫酸鋇固體中加入稀硝酸:3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴加甲基橙試劑顯紅色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | [H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | [OH-]/[H+]=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水電離的[H+]=1.0×10-13 mol•L-1的溶液中:K+、NH4+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
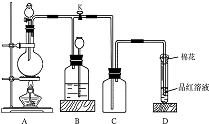 如圖所示裝置為銅跟濃硫酸反應制取二氧化硫的實驗裝置,請回答下列問題:
如圖所示裝置為銅跟濃硫酸反應制取二氧化硫的實驗裝置,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 目前工業上常用電解熔融氯化鈉法制鈉,電解時可用鐵作陽極 | |
| B. | 電解熔融CaCl2時,金屬鈣在陽極生成 | |
| C. | 可用電解飽和MgCl2溶液的方法獲得金屬鎂 | |
| D. | 電解熔融Al2O3制備金屬鋁時,要加入冰晶石,使Al2O3在較低溫度下熔解 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgNO3,Na2CO3,HNO3 | B. | Na2CO3,AgNO3,HNO3 | ||
| C. | AgNO3,K2CO3,HNO3 | D. | AgNO3,Na2CO3,HCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com