
| 反應 | 大氣固氮 N2(g)+O2(g)?2NO(g) | 工業固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

分析 (1)①溫度越高,K越大,說明升高溫度,平衡正移;
②K值很小,轉化率很小;
③合成氨反應中,在500℃左右催化劑活性最高;
(2)合成氨反應為放熱反應,升高溫度,轉化率減小;增大壓強平衡正向移動,轉化率增大;
(3)氮氣在陰極得電子生成氨氣;
(4)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由蓋斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),據此分析.
解答 解:(1)①由表格數據可知,溫度越高,K越大,說明升高溫度,平衡正移,則正反應方向為吸熱反應,故答案為:吸熱;
②由表格數據可知,2000℃時,K=0.1,K值很小,則轉化率很小,不適合大規模生產,所以人類不適合大規模模擬大氣固氮,
故答案為:K值小,正向進行的程度小(或轉化率低),不適合大規模生產;
③合成氨反應中,反應溫度越高,反應速率越快,但是該反應為放熱反應,溫度高轉化率會降低,而且在500℃左右催化劑活性最高,所以從催化劑活性等綜合因素考慮選擇500℃左右合適;
故答案為:從反應速率角度考慮,高溫更好,但從催化劑活性等綜合因素考慮選擇500℃左右合適;
(2)合成氨反應為放熱反應,升高溫度,轉化率減小,所以圖A正確,B錯誤;該反應正方向為體積減小的方向,增大壓強平衡正向移動,轉化率增大,р2的轉化率大,則р2大;
故答案為:A;р2>р1;
(3)電解池中氮氣在陰極得電子生成氨氣,其電極方程式為:N2+6e-+6H+=2NH3,故答案為:N2+6e-+6H+=2NH3;
(4)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由蓋斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案為:+1530kJ•mol-1.
點評 本題考查了平衡常數的應用、合成氨反應的條件選擇、影響化學平衡的因素、電解原理的應用、蓋斯定律的應用等,題目難度中等,側重于基礎知識的綜合應用考查,注意把握K與溫度的關系以及影響化學平衡的因素.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度可使該反應的逆反應速率降低 | |
| B. | 反應達平衡后,CO的反應速率保持不變 | |
| C. | 使用高效催化劑可有效提高正、逆反應速率 | |
| D. | 單位時間內消耗CO和N2的物質的量之比為2:1時,反應達到平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 把CaO放入水中:CaO═Ca2++O2- | |
| B. | 加熱NaHSO4至熔化:NaHSO4═Na++H++SO42- | |
| C. | 把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42- | |
| D. | 把NaCl放入水中:NaCl═Na++Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
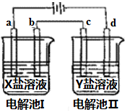 如圖所示的電解池I和II中,a、b、c和d均為Pt電極.電解過程中,電極b和d上沒有氣體逸出,但質量均增大,且增重b<d.符合上述實驗結果的鹽溶液是( )
如圖所示的電解池I和II中,a、b、c和d均為Pt電極.電解過程中,電極b和d上沒有氣體逸出,但質量均增大,且增重b<d.符合上述實驗結果的鹽溶液是( )| 選項 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | KNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | CuSO4 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com