
| A. | 自行車的鋼圈上鍍一層鉻,防止生銹 | |
| B. | 外加直流電源保護鋼閘門時,鋼閘門與電源的負極相連 | |
| C. | 鋼鐵發生吸氧腐蝕的正極反應:2H2O+O2+4e-═4OH- | |
| D. | 鋼鐵發生析氫腐蝕的負極反應:Fe-3e-═Fe3+ |
分析 A.鉻能夠阻止了鐵與空氣、水的接觸;
B.金屬的腐蝕與防護中如果有外接電源,此方法為外加電源的陰極保護法;
C.金屬的吸氧腐蝕過程中正極氧氣得到電子結合水生成氫氧根離子;
D.鋼鐵的析氫腐蝕的負極是鐵放電生成二價鐵離子.
解答 解:A.自行車的鋼圈上鍍上一層鉻阻止了鐵與空氣、水的接觸,從而防止金屬鐵防銹,故A正確;
B.將鋼閘門與外加電源負極相連,陰極上電解質溶液中陽離子得電子發生還原反應,此方法為外加電源的陰極保護法,可防止鋼閘門腐蝕,故B正確;
C.金屬的吸氧腐蝕過程中正極氧氣得到電子結合水生成氫氧根離子,正極反應:2H2O+O2+4e-═4OH-,故C正確;
D.鋼鐵發生析氫腐蝕的負極反應:Fe-2e-═Fe2+,故D錯誤;
故選:D.
點評 本題考查了金屬的腐蝕與防護,明確金屬的電化學腐蝕原理、原電池、電解池工作原理是解題關鍵,題目難度不大.


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:解答題
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 粗鋅與稀硫酸反應比純鋅快,說明粗鋅中含有更活潑的金屬 | |
| B. | 新制氯水顯酸性,滴加少量紫色石蕊溶液,溶液始終呈紅色 | |
| C. | 常溫下,弱酸酸式鹽NaHA的pH=6,說明HA-的電離程度大于其水解程度 | |
| D. | 一定溫度下,反應2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 有一種瓦斯分析儀能夠在煤礦巷道中的甲烷達到一定濃度時,通過傳感器顯示出來.該瓦斯分析儀工作原理類似燃料電池的工作原理,其裝置如圖所示,其中的固體電解質是Y2O3-Na2O,O2-可以在其中自由移動.下列有關敘述正確的是( )
有一種瓦斯分析儀能夠在煤礦巷道中的甲烷達到一定濃度時,通過傳感器顯示出來.該瓦斯分析儀工作原理類似燃料電池的工作原理,其裝置如圖所示,其中的固體電解質是Y2O3-Na2O,O2-可以在其中自由移動.下列有關敘述正確的是( )| A. | 電極a是正極,電極反應式為CH4+4O2--8e-=CO2+2H2O | |
| B. | 電極b是正極,O2-由電極b流向電極a | |
| C. | 瓦斯分析儀工作時,電池內電路中電子由電極a流向電極b | |
| D. | 當電路中有0.4mol電子轉移時,a極有2.24L(標況)甲烷放電 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 電滲析法是一種利用A、B離子交換膜進行海水淡化的方法,其原理如圖所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極.下列敘述中正確的是( )
電滲析法是一種利用A、B離子交換膜進行海水淡化的方法,其原理如圖所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極.下列敘述中正確的是( )| A. | 是原電池裝置,把化學能轉化為電能 | |
| B. | 是電解裝置,只發生物理變化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是陰離子交換膜,B膜是陽離子交換膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
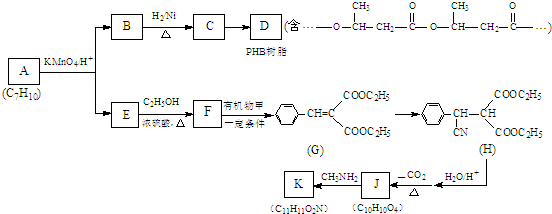
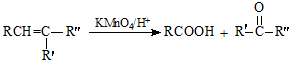
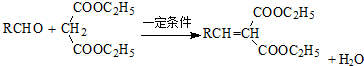
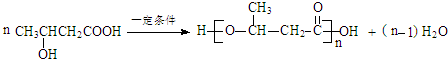 .
. .
.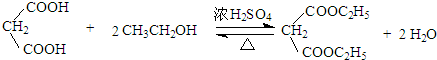 .
.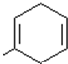 .
.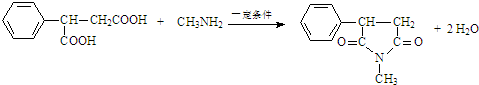 .
.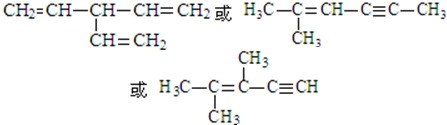 (寫出一種即可).
(寫出一種即可).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 實驗 | 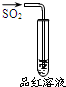 | 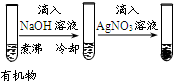 |  | 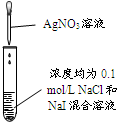 |
| 現象 | 品紅褪色 | 最后試管有淺黃色沉淀 | 最后一滴溶液使酚酞由無色變為粉紅色,且30秒不復原 | 出現白色沉淀 |
| 結論 | SO2有強氧化性 | 有機物中含有溴原子 | 滴定達到終點 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上學期第13次周測理科綜合化學試卷 題型:實驗題
硫化亞鐵煅燒得到的燒渣的主要成分為FeO、Fe3O4和Fe2O3等。利用該燒渣制備鐵紅和副產品無氯鉀肥的流程如下:
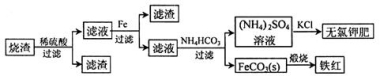
回答下列問題:
(1)煅燒硫化亞鐵若生成Fe2O3和SO2,則生成標準狀況下11.2L SO2氣體,轉移電子的物質的量為____________。
(2)該流程中加入鐵粉的作用是____________(用離子方程式表示)。
(3)已知四種鹽的溶解度隨溫度變化的曲線如圖所示。請回答下列問題:
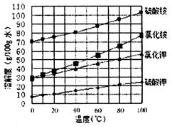
①向濾液II中加入NH4HCO3溶液所發生反應的離子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到無氯鉀肥應進行的操作為_________、________、洗滌、干燥等;反應的化學方程式為_______________。
(4)用含少量硫酸亞鐵和硫酸鐵的硫酸銅溶液制備CuSO4·5H2O的流程如下:
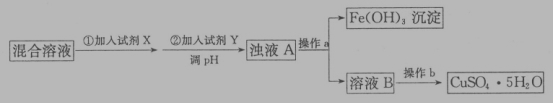
加入試劑X的目的是_____,調節溶液pH的試劑Y可能是_____(填字母編號)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+為0.2mol·L-1的溶液,欲除盡Fe3+(當離子濃度小于1*10-5mol·L-1時,離子已沉淀完全,)調整溶液pH的精確范圍是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com