
【題目】已知:①能量越低的物質就越穩定,②白磷轉化成紅磷是放熱反應。據此,下列判斷或說法中正確的是( )
A.在相同的條件下,紅磷比白磷能量高
B.在相同的條件下,白磷比紅磷穩定
C.紅磷和白磷的結構不同
D.紅磷容易發生自燃而白磷則不會自燃
科目:高中化學 來源: 題型:
【題目】請參考題中圖表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根據要求回答問題:
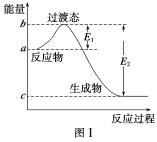
(1)圖Ⅰ是1 mol NO2(g)和1 mol CO(g)反應生成CO2和NO過程中的能量變化示意圖,若在反應體系中加入催化劑,反應速率增大,E1的變化是________(填“增大”、“減小”或“不變”,下同),ΔH的變化是________。
(2)如表所示是部分化學鍵的鍵能參數:
化學鍵 | P—P | P—O | O===O | P===O |
鍵能/kJ·mol-1 | a | b | c | x |
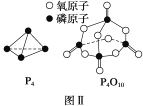
已知白磷的燃燒熱為d kJ·mol-1,白磷及其完全燃燒的產物的結構如圖Ⅱ所示,則表中x=___ _____ kJ·mol-1(用含a、b、c、d的代表數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的用途不正確的是
A. 高純度的單質硅可用于制作計算機芯片 B. 鈉鉀合金可在快中子反應堆中作熱交換劑
C. 二氧化硫不可用作熏蒸粉絲 D. 碳酸鈉可用于治療胃酸過多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關有機物結構、性質的分析正確的是
A. 乙醇、乙酸均能與 Na 反應放出 H2,二者分子中官能團相同
B. 乙烯和苯都能與 H2 發生加成反應,說明二者均含有碳碳雙鍵
C. 苯可以在空氣中燃燒,但不能被酸性高錳酸鉀溶液氧化
D. 乙醇在銅催化作用下,能發生還原反應生成乙醛
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(16分)25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
請回答下列問題:
(1)CH3COOH、H2CO3、HClO的酸性由強到弱的順序為__________。
(2)同濃度CH3COO-、HCO3-、CO32-、ClO-結合H+的能力由強到弱的順序為__________。
(3)將少量CO2氣體通入NaClO溶液中,寫出反應的離子方程式:_______。
(4)常溫下0.1 mol·L-1的CH3COOH溶液在加水稀釋過程中,填寫下列表達式中的數據變化情況(填“變大”、“變小”或“不變”)
①![]() ______;②
______;②![]() ______;
______;
③![]() _______;④
_______;④![]() _______。
_______。
(5)體積為10mLpH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程中pH變化如圖所示,則HX的電離平衡常數______(填“大于”、“等于”或“小于”)醋酸的電離平衡常數:理由是______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】選修3——物質結構與性質]
X、Y、Z、W、Q、R均為前四周期元素,且原子序數依次增大。其相關信息如下表所示:
X元素的基態原子中電子分布在三個不同的能級中,且每個能級中的電子總數相同 |
Y元素的氣態氫化物與其最高價氧化物對應的水化物能發生化合反應 |
Z元素的族序數是其周期數的三倍 |
W原子的第一至第六電離能分別為: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
Q為前四周期中電負性最小的元素 |
元素R位于周期表的第10列 |
回答下列問題:
(1)Y元素的基態原子的電子排布式為_____________,其第一電離能比Z元素原子的第一電離能________(填“高”或“低”)
(2)X的氯化物的熔點比Q的氯化物的熔點_______________(填“高”或“低”),理由是___________________
(3)光譜證實元素W的單質與強堿性溶液反應有W(OH)4]-生成,則W(OH)4]-中存在_______(填字母)
a.極性共價鍵 b.非極性共價鍵 c.配位鍵 d.氫鍵
(4)含有X、R和鎂三種元素的某種晶體具有超導性,其結構如下圖所示。則該晶體的化學式為_________;晶體中每個鎂原子周圍距離最近的R原子有___________個。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廢催化劑含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同學用15.0 g該廢催化劑為原料,回收鋅和銅。采用的實驗方案如下,回答下列問題:
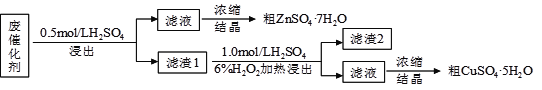
已知:ZnS與稀硫酸反應,且化合價不變; CuS既不溶解于稀硫酸,也不與稀硫酸反應
(1)在下列裝置中,第一次浸出反應裝置最合理的___________(填標號)。

(2)濾液1中含有Fe2+,選用提供的試劑進行檢驗,檢驗方法如下: 。
(提供的試劑:稀鹽酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本實驗要用到抽濾,設所用的洗滌劑為X,抽濾洗滌沉淀的操作 。
(4)寫出第二次浸出的化學反應方程式 ,向盛有濾渣1的反應器中加H2SO4和H2O2溶液,應先加 。
(5)濾渣2的主要成分是 。濃縮、結晶得到硫酸鋅晶體的主要儀器名稱是 。
(6)某同學在實驗完成之后,得到1.50 g CuSO4·5H2O,則銅的回收率為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com