
(8分)經研究知Cu2+對H2O2分解也具有催化作用,為比較Fe3+和Cu2+對H2O2分解的催化效果,某研究小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題:
(1)定性分析:如圖甲可通過觀察___________________________________定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是____________________,
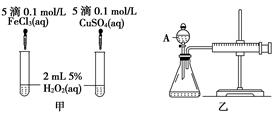
寫出H2O2在二氧化錳作用下發生反應的化學方程式:
_____________________________________________________。
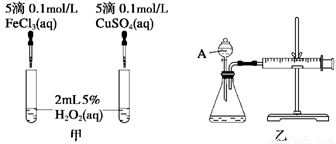
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為________,實驗中需要測量的數據是_________________。
(1)反應產生氣泡的快慢 控制陰離子相同,排除陰離子的干擾 2H2O2 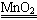
2H2O+O2↑
(2)分液漏斗
收集40 mL氣體所需要的時間
【解析】首先明確實驗目的:比較Fe3+和Cu2+對H2O2分解的催化效果;
(1)圖甲:兩試管中盛有等體積、等濃度的H2O2,分別滴入氯化鐵、硫酸銅溶液,通過產生氣泡的快慢即可比較Fe3+和Cu2+對H2O2分解的催化效果(保持其他條件相同,只改變催化劑);
氯離子中氯為-1價,有還原性,H2O2有氧化性,故Cl-和H2O2可發生氧化還原反應,應排除Cl-的干擾;
(2)“收集40 mL氣體所需要的時間”即通過計算分別用Fe3+、Cu2+催化時生成O2的速率,來定量比較Fe3+和Cu2+對H2O2分解的催化效果;


科目:高中化學 來源: 題型:
(10分)經研究知Cu2+對H2O2分解也具有催化作用,為比較Fe3+和Cu2+對H2O2分解的催化效果,某研究小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題:
(1) 定性分析:如圖甲可通過觀察____________________________________,定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是____________________________________________________________________,
寫出H2O2在二氧化錳作用下發生反應的化學方程式
____________________________________________________________________。
(2) 定量分析:如圖乙所示,實驗時均以生成40mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為________,實驗中需要測量的數據是___________________________________________________________。
檢查乙裝置氣密性的方法是
____________________________________________________________________。
(3) 0.6mol X氣體和0.6mol Y氣體混合于2 L密閉容器中,發生如下反應:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若測得以Z的物質的量濃度變化表示的反應速率為0.1 mol/(L·min),則前2 min內,用X的物質的量濃度變化表示的平均反應速率為________;2 min末時Y的物質的量濃度為________;化學方程式中,Z的化學計量數n=________。
(4) 在一定溫度下,反應:2A(s)+2B(g) C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
A.容器內的壓強不隨時間而變化
B.混合氣的密度不再隨時間而變化
C.A的質量不再改變
D.平衡混合氣體的平均相對分子質量不再改變
查看答案和解析>>
科目:高中化學 來源:2012學年四川省南山中學高一下學期期中考試化學試卷(帶解析) 題型:實驗題
(10分)經研究知Cu2+對H2O2分解也具有催化作用,為比較Fe3+和Cu2+對H2O2分解的催化效果,某研究小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題:
(1) 定性分析:如圖甲可通過觀察____________________________________,定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是____________________________________________________________________,
寫出H2O2在二氧化錳作用下發生反應的化學方程式
____________________________________________________________________。
(2) 定量分析:如圖乙所示,實驗時均以生成40mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為________,實驗中需要測量的數據是___________________________________________________________。
檢查乙裝置氣密性的方法是
____________________________________________________________________。
(3) 0.6 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,發生如下反應:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若測得以Z的物質的量濃度變化表示的反應速率為0.1 mol/(L·min),則前2 min內,用X的物質的量濃度變化表示的平均反應速率為________;2 min末時Y的物質的量濃度為________;化學方程式中,Z的化學計量數n=________。
(4) 在一定溫度下,反應:2A(s)+2B(g)  C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
| A.容器內的壓強不隨時間而變化 |
| B.混合氣的密度不再隨時間而變化 |
| C.A的質量不再改變 |
| D.平衡混合氣體的平均相對分子質量不再改變 |
查看答案和解析>>
科目:高中化學 來源:2012學年四川省高一下學期期中考試化學試卷(解析版) 題型:實驗題
(10分)經研究知Cu2+對H2O2分解也具有催化作用,為比較Fe3+和Cu2+對H2O2分解的催化效果,某研究小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題:
(1) 定性分析:如圖甲可通過觀察____________________________________,定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是____________________________________________________________________,
寫出H2O2在二氧化錳作用下發生反應的化學方程式
____________________________________________________________________。

(2) 定量分析:如圖乙所示,實驗時均以生成40mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為________,實驗中需要測量的數據是___________________________________________________________。
檢查乙裝置氣密性的方法是
____________________________________________________________________。
(3) 0.6 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,發生如下反應:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若測得以Z的物質的量濃度變化表示的反應速率為0.1 mol/(L·min),則前2 min內,用X的物質的量濃度變化表示的平均反應速率為________;2 min末時Y的物質的量濃度為________;化學方程式中,Z的化學計量數n=________。
(4) 在一定溫度下,反應:2A(s)+2B(g) 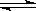 C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
A.容器內的壓強不隨時間而變化
B.混合氣的密度不再隨時間而變化
C.A的質量不再改變
D.平衡混合氣體的平均相對分子質量不再改變
查看答案和解析>>
科目:高中化學 來源:2013屆山東省高二上學期期中模塊學分認定考試化學試卷 題型:實驗題
(10分)經研究知Cu2+對H2O2分解也具有催化作用,為比較Fe3+和Cu2+對H2O2分解的催化效果,某研究小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題:
(1) 定性分析:如圖甲可通過觀察____________________________________,定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是____________________________________________________________________,
寫出H2O2在二氧化錳作用下發生反應的化學方程式
____________________________________________________________________。
(2) 定量分析:如圖乙所示,實驗時均以生成40mL氣體為準,其他可能影響實驗的因素均已忽略。圖中儀器A的名稱為________,實驗中需要測量的數據是___________________________________________________________。
檢查乙裝置氣密性的方法是
____________________________________________________________________。
(3) 0.6 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,發生如下反應:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若測得以Z的物質的量濃度變化表示的反應速率為0.1 mol/(L·min),則前2 min內,用X的物質的量濃度變化表示的平均反應速率為________;2 min末時Y的物質的量濃度為________;化學方程式中,Z的化學計量數n=________。
(4) 在一定溫度下,反應:2A(s)+2B(g) 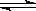 C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
C(g)+D(g)在恒容容器中進行,不能說明該反應已經達到平衡的是________
A.容器內的壓強不隨時間而變化
B.混合氣的密度不再隨時間而變化
C.A的質量不再改變
D.平衡混合氣體的平均相對分子質量不再改變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com