
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 開始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
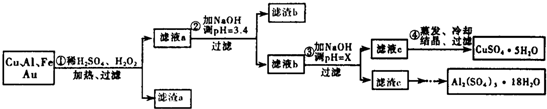
分析 由流程可知,金屬混合物加入稀硫酸鋁、鐵溶解,加入過氧化氫,亞鐵離子被氧化為鐵離子,銅在酸性溶液中被過氧化氫氧化為銅離子,過濾得到濾渣a為Au,濾液中主要含有鐵離子鋁離子和銅離子,加入氫氧化鈉溶液調節溶液PH=3.4,依據題干信息,是為了沉淀鐵離子,過濾得到濾渣b為Fe(OH)3,濾液為鋁離子和銅離子,加入氫氧化鈉溶液調節溶液PH=5.2-5.4使鋁離子全部沉淀過濾得到濾渣C為Al(OH)3,用硫酸溶解后蒸發、濃縮、冷卻、結晶、過濾得到Al2(SO4)2•18H2O晶體;得到濾液為硫酸銅溶液,通過蒸發濃縮,冷卻結晶,過濾洗滌得到硫酸銅晶體,
(1)過濾操作用到的儀器有燒杯、漏斗、玻璃棒;
(2)銅被雙氧水氧化成銅離子,據此寫出反應的離子方程式;
(3)Cu、Al及少量Fe、Au等金屬的混合物,其中銅、鋁、鐵都發生反應而溶解,Au化學性質穩定,成為濾渣a的主要成分;
(4)濾渣c是氫氧化鋁,根據部分陽離子以氫氧化物形式沉淀時溶液的pH表,選擇使氫氧化鋁沉淀完全且氫氧化銅不沉淀的PH;
(5)①依據滴定實驗發生的反應的定量關系進行計算樣品中所含銅離子物質的量,結合元素守恒計算硫酸銅 晶體質量分數;
②樣品中含有硫酸鈉,測定硫酸根離子含量不能計算得到硫酸銅晶體的含量;
(6)濾渣C主要是氫氧鋁,加入硫酸溶解后通過這蒸發濃縮,冷卻結晶,過濾洗滌得到晶體Al2(SO4)3•18H2O.
解答 解:由流程可知,金屬混合物加入稀硫酸鋁、鐵溶解,加入過氧化氫,亞鐵離子被氧化為鐵離子,銅在酸性溶液中被過氧化氫氧化為銅離子,過濾得到濾渣a為Au,濾液中主要含有鐵離子鋁離子和銅離子,加入氫氧化鈉溶液調節溶液PH=3.4,依據題干信息,是為了沉淀鐵離子,過濾得到濾渣b為Fe(OH)3,濾液為鋁離子和銅離子,加入氫氧化鈉溶液調節溶液PH=5.2-5.4使鋁離子全部沉淀過濾得到濾渣C為Al(OH)3,用硫酸溶解后蒸發、濃縮、冷卻、結晶、過濾得到Al2(SO4)2•18H2O晶體;得到濾液為硫酸銅溶液,通過蒸發濃縮,冷卻結晶,過濾洗滌得到硫酸銅晶體;
(1)過濾是化學實驗中經常用到的實驗操作.過濾操作中用到的玻璃儀器有燒杯、玻璃棒、漏斗,故答案為:燒杯、漏斗、玻璃棒;
(2)Cu可溶于稀硫酸與H2O2的混合溶液,銅被氧化成銅離子,雙氧水生成水,根據化合價升降相等配平,反應的離子方程式是Cu+H2O2+2H+═Cu2++2H2O,
故答案為:Cu+H2O2+2H+═Cu2++2H2O;
(3)由于Cu、Al、Fe都因反應溶解于溶液中,剩下Au不反應,過濾到了濾渣a中,故答案為:Au;
(4)加入氫氧化鈉溶液調節PH=x,目的是生成氫氧化鋁沉淀,氫氧化鋁開始沉淀pH=4,沉淀完全pH=5.2,氫氧化銅開始沉淀pH=5.4,所以選擇的pH范圍是:5.2≤X<5.4,
故答案為:5.2≤X<5.4;
(5)由2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-可知,
反應的定量關系為:2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0mol•L-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸銅晶體物質的量為1.4×10-2mol,所以硫酸銅晶體的質量分數=$\frac{1.4×1{0}^{-2}mol×250g/mol}{4.0g}$×100%=87.5%,
故答案為:87.5%;
②依據流程分析判斷,樣品中含有硫酸鈉,不能通過測定硫酸根離子的方法計算得到硫酸銅晶體的質量分數,故答案為:樣品中含有Na2SO4等雜質;
(6)分析流程可知,濾渣C主要是氫氧鋁,加入硫酸溶解后通過這蒸發濃縮,冷卻結晶,過濾洗滌得到晶體Al2(SO4)3•18H2O,
故答案為:將濾渣c加入稀硫酸溶解,然后蒸發、濃縮、冷卻、結晶、過濾得到Al2(SO4)2•18H2O晶體.
點評 本題考查混合物的分離和提純方法的綜合應用、制備方案的設計,題目難度中等,明確實驗目的和實驗原理為解答關鍵,注意掌握鋁離子、鐵離子、銅離子的分離方法和性質判斷,試題培養了學生的分析能力及化學實驗能力.


 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案科目:高中化學 來源: 題型:多選題

| A. | 濃硫酸的還原產物是SO2 | |
| B. | 該裝置可隨時控制反應的發生或停止 | |
| C. | ①中有白色固體生成,加水后溶液呈藍色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空氣污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
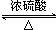 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 20 g D2O所含的電子數為10 NA | |
| B. | 25℃時,pH=13的Ba(OH)2溶液中含有的OH-數目為0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去電子數目為2 NA | |
| D. | 氫氣與氯氣反應生成標準狀況下22.4 L氯化氫,斷裂化學鍵總數為2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
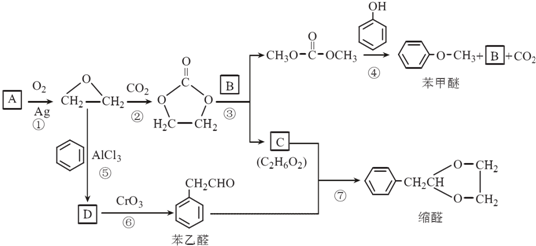
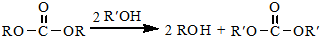
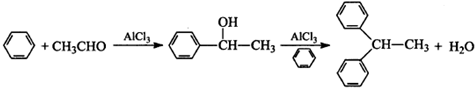
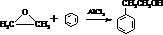 .
.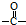 結構,核磁共振氫譜有4組峰,峰面積之比為3:2:2:1.
結構,核磁共振氫譜有4組峰,峰面積之比為3:2:2:1.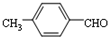 ,
,
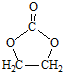 的合成路線,設計一條由2-氯丙烷和必要的無機試劑制備
的合成路線,設計一條由2-氯丙烷和必要的無機試劑制備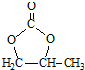 的合成路線(注明必要的反應條件).
的合成路線(注明必要的反應條件).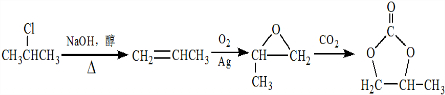 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
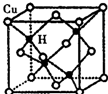 銅是第四周期最重要的過渡元素之一,其單質及化合物具有廣泛用途.CuH的晶體結構如圖所示,若CuH的密度為d g•cm-3,阿伏加德羅常數的值為NA,則該晶胞的邊長為$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
銅是第四周期最重要的過渡元素之一,其單質及化合物具有廣泛用途.CuH的晶體結構如圖所示,若CuH的密度為d g•cm-3,阿伏加德羅常數的值為NA,則該晶胞的邊長為$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com