
【題目】為減少二氧化碳排放,我國科學家設計熔鹽電解池捕獲二氧化碳的裝置,如下圖所示。下列說法不正確的是

A.CO2過量排放是導致溫室效應的原因之一
B.過程②中C2O52-在a極上發生了還原反應
C.過程③中的反應可表示為:CO2+O2-=CO32-
D.CO2最終轉化為C和O2
【答案】B
【解析】
由裝置圖可知,a極上,電極反應有:4CO2+2O2-=2C2O52-,2C2O52--4e-=4CO2↑+O2↑,總的電極反應為:2O2--4e-=O2↑;b極上,電極反應有:CO2+O2-=CO32-,CO32-+4e-=C+3O2-,總的電極反應為:CO2+4e-=C+2O2-;熔鹽電解池的總的化學方程式為:CO2![]() C+O2,據此分析解答。
C+O2,據此分析解答。
A.太陽短波輻射可以透過大氣射入地面,而地面增暖后放出的長波輻射卻被大氣中的二氧化碳等物質所吸收,從而產生大氣變暖的效應,二氧化碳過量排放導致大氣中二氧化碳含量過高,溫度逐漸升高,形成“溫室效應”,故A正確;
B.根據分析,過程②中,a極的電極反應為:2C2O524e=4CO2↑+O2↑,該電極反應為氧化反應,故B錯誤;
C.根據題中信息,可以推出過程③中的反應可表示為:CO2+O2-=CO32-,故C正確;
D.根據分析,熔鹽電解池的總的化學方程式為:CO2![]() C+O2,故D正確;
C+O2,故D正確;
答案選B。


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:
【題目】多相催化反應是在催化劑表面通過吸附、解吸過程進行的。我國學者發現T℃時(各物質均為氣態),甲醇與水在銅基催化劑上的反應機理和能量圖如圖:
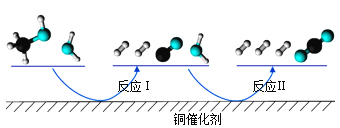

下列說法正確的是( )
A.反應Ⅱ的熱化學方程式為:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的總能量大于1molCO2(g)和3molH2(g)的總能量
C.選擇優良的催化劑降低反應Ⅰ和Ⅱ的活化能,有利于減少過程中的能耗
D.CO(g)在反應中生成又消耗,CO(g)可認為是催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數,下列敘述正確的是
A. 13g鋅與一定量濃硫酸恰好完全反應,生成氣體的分子數為0.2NA
B. 71g氯氣通入足量的水中,反應中轉移的電子總數為NA
C. 由D和18O所組成的水11g,所含的中子數為4NA
D. 1molBrCl與H2O完全反應生成氯化氫和次溴酸,轉移的電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )。
A.在離子化合物中,只存在離子鍵,沒有共價鍵
B.非極性鍵只存在于雙原子的單質分子(如![]() )中
)中
C.原子序數為11與9的元素能夠形成離子化合物
D.由不同元素組成的含多個原子的分子中,只存在極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2mol金屬鈉和1mol氯氣反應的能量關系如圖所示,下列說法不正確的( )
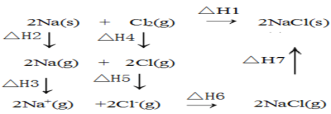
A.△H2+△H3+△H4+△H5+△H6+△H7=△H1
B.△H4的值數值上和Cl-Cl共價鍵的鍵能相等
C.△H5<0,在相同條件下,2Br(g)的△H5′<△H5
D.△H7<0,且該過程形成離子鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(NA表示阿伏加德羅常數的值) ( )
A. 在常溫常壓下,11.2 L N2含有的原子數為NA
B. 32 g O2在標準狀況下所占體積約為22.4 L
C. 標準狀況下,18 g H2O所占的體積約為22.4 L
D. 在同溫同壓下,相同體積的任何氣體單質所含的原子數相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖A、B、C、D、E、F等幾種常見有機物之間的轉化關系圖,其中A是面粉的主要成分;C和E反應能生成F,F具有香味。
![]()
在有機物中,凡是具有—CHO結構的物質,具有如下性質:
(1)與新制氫氧化銅懸濁液反應,產生磚紅色沉淀;
(2)在催化劑作用下, —CHO被氧氣氧化為—COOH,即![]() 。
。
根據以上信息及各物質的轉化關系完成下列各題。
(1)B的化學式為_________,C的結構簡式為__________。
(2)其中能與新制氫氧化銅懸濁液反應產生磚紅色沉淀的物質有_________(填名稱)。
(3)C→D的化學方程式為______________。
(4)C + E→ F的化學方程式為 ______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定穩定下,在容積不變的密閉容器中,進行如下可逆反應:![]() ,下列能表明該反應已達到平衡狀態的是
,下列能表明該反應已達到平衡狀態的是
①![]()
②![]()
③![]()
④混合氣的密度保持不變
⑤混合氣體的平均摩爾質量不變
A.僅④B.僅④⑤
C.僅①④D.僅③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用Cl2生產某些含氯有機物時會生成副產物HCl,利用下列反應可實現氯的循環利用:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒溫恒容的密閉容器中,充入一定量的反應物發生上述反應,能充分說明該反應達到化學平衡狀態的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒溫恒容的密閉容器中,充入一定量的反應物發生上述反應,能充分說明該反應達到化學平衡狀態的是( )
A.氣體的質量不再改變
B.氯化氫的轉化率不再改變
C.斷開4molH—Cl鍵的同時生成4molH—O鍵
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com