

| A. | X試劑可用Na2SO3飽和溶液 | |
| B. | 步驟Ⅲ的離子反應:2Br-+Cl2═2Cl-+Br2 | |
| C. | 工業上每獲得1molBr2,需要消耗Cl244.8L | |
| D. | 步驟Ⅳ包含萃取、分液和蒸餾 |
分析 A、亞硫酸根離子可以和氧化性的溴單質間發生氧化還原反應;
B、氯氣具有氧化性,可已將溴離子氧化為溴單質;
C、根據氧化還原反應的方程式計算即可,標準狀況每獲得1molBr2,需要消耗標況下Cl222.4L;
D、溴單質在有機溶劑溶解度大,可以利用有機溶劑萃取溴單質,得到萃取液通過蒸餾得到純溴.
解答 解:A、亞硫酸根離子可以和氧化性的溴單質間發生氧化還原反應,可以用所給物質來吸收溴單質,故A正確;
B、氯氣具有氧化性,可以將溴離子氧化為溴單質,即2Br-+Cl2═2Cl-+Br2,故B正確;
C、發生2Br-+Cl2═2Cl-+Br2,每獲得1molBr2,需要消耗標況下Cl222.4L,故C錯誤;
D、從溴水中提取溴可以采用萃取、分液和蒸餾的方法,故D正確.
故選C.
點評 本題考查學生還水體秀的基本原理以及物質分離和提純的方法等方面的知識,注意知識的遷移和應用是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 欲將蛋白質從水中析出而又不改變它的性質,可加入AgNO3溶液 | |
| B. | 乙醇可以被氧化為乙酸,二者都能發生酯化反應 | |
| C. | 淀粉溶液中加入一定量稀硫酸,共熱一段時間后,向溶液中加入新制氫氧化銅懸濁液并加熱煮沸,未見紅色固體產生,證明淀粉沒有發生水解 | |
| D. | 可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金剛石晶體中的最小碳原子環由6個碳原子構成 | |
| B. | 金剛石晶體中的碳原子是sp2雜化的 | |
| C. | 12g金剛石中含有C-C鍵的個數為4NA | |
| D. | 金剛石化學性質穩定,即使在高溫下也不會和O2反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
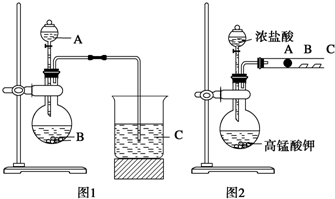
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙烯氣相直接水合反應,在其他條件相同時,分別測得C2H4的平衡轉化率在不同壓強(P1、P2)下隨溫度變化的曲線如圖.結合曲線歸納平衡轉化率
乙烯氣相直接水合反應,在其他條件相同時,分別測得C2H4的平衡轉化率在不同壓強(P1、P2)下隨溫度變化的曲線如圖.結合曲線歸納平衡轉化率查看答案和解析>>
科目:高中化學 來源: 題型:解答題
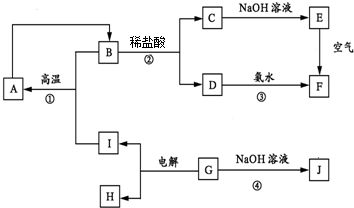
 ,E的化學式為Fe(OH)2.
,E的化學式為Fe(OH)2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com