
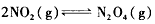 達到平衡。
達到平衡。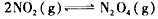 的平衡常數K。_______________________
的平衡常數K。_______________________


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
(1)已知:2NO2(g)====N2O4(g) ΔH=-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g) ![]() N2O4(g)達到平衡。
N2O4(g)達到平衡。
其他條件不變時,下列措施能提高NO2轉化率的是______________(填字母)。
A.減小NO2的濃度
B.降低溫度
C.增加NO2的濃度
D.升高溫度
(2)
(3)![]() N2O4(g)的平衡常數K。
N2O4(g)的平衡常數K。
(4)現用一定量的Cu與足量的濃HNO3反應,制得
查看答案和解析>>
科目:高中化學 來源: 題型:
(I)一定溫度下,向Na2CO3溶液中加入BaCl2和K2SO4,當兩種沉淀共存時,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)聯氨(N2H4)及其衍生物是一類重要的火箭燃料,N2H4與N2O4反應能放出大量的熱。
(1)已知:2NO2(g)![]() N2O4(g) ??H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)
N2O4(g) ??H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)![]() N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
A.減小NO2的濃度 B.降低溫度 C.增加NO2的濃度 D.升高溫度
(2)25 ℃時,1.00 g N2H4(l)與足量N2O4(l)完全反應生成N2(g)和H2O(l),放出19.14 kJ的熱量。則反應2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的??H = kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密閉容器中N2O4和NO2的混合氣體達到平衡時,
c(NO2) = 0.0300 mol·L-1、c(N2O4) = 0.0120 mol·L-1。 則反應2NO2(g)![]() N2O4(g)的
N2O4(g)的
平衡常數K = 。
(4)現用一定量的Cu與足量的濃HNO3反應,制得1.00 L已達到平衡的N2O4和NO2混合氣體(17 ℃、1.01×105 Pa),理論上至少需消耗Cu 克。
查看答案和解析>>
科目:高中化學 來源: 題型:
(I)一定溫度下,向Na2CO3溶液中加入BaCl2和K2SO4,當兩種沉淀共存時,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)聯氨(N2H4)及其衍生物是一類重要的火箭燃料,N2H4與N2O4反應能放出大量的熱。
(1)已知:2NO2(g)![]() N2O4(g) H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)![]() N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
A.減小NO2的濃度 B.降低溫度 C.增加NO2的濃度 D.升高溫度
(2)25 ℃時,1.00 g N2H4(l)與足量N2O4(l)完全反應生成N2(g)和H2O(l),放出19.14 kJ的熱量。則反應2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的H = kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密閉容器中N2O4和NO2的混合氣體達到平衡時,
c(NO2) = 0.0300 mol·L-1、c(N2O4) = 0.0120 mol·L-1。則反應2NO2(g)![]() N2O4(g)的
N2O4(g)的
平衡常數K = 。
(4)現用一定量的Cu與足量的濃HNO3反應,制得1.00 L已達到平衡的N2O4和NO2混合氣體(17 ℃、1.01×105 Pa),理論上至少需消耗Cu 克。
查看答案和解析>>
科目:高中化學 來源:2011屆江西省樟樹中學高三上學期第四次月考(理綜)化學部分 題型:填空題
(I)一定溫度下,向Na2CO3溶液中加入BaCl2和K2SO4,當兩種沉淀共存時,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)聯氨(N2H4)及其衍生物是一類重要的火箭燃料,N2H4與N2O4反應能放出大量的熱。
(1)已知:2NO2(g) N2O4(g) ?H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)
N2O4(g) ?H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g) N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是 。
| A.減小NO2的濃度 | B.降低溫度 | C.增加NO2的濃度 | D.升高溫度 |
 N2O4(g)的
N2O4(g)的查看答案和解析>>
科目:高中化學 來源:2010-2011學年江西省高三上學期第四次月考(理綜)化學部分 題型:填空題
(I)一定溫度下,向Na2CO3溶液中加入BaCl2和K2SO4,當兩種沉淀共存時,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)聯氨(N2H4)及其衍生物是一類重要的火箭燃料,N2H4與N2O4反應能放出大量的熱。
(1)已知:2NO2(g) N2O4(g)
H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g)
N2O4(g)
H =-57.20 kJ·mol-1。一定溫度下,在密閉容器中反應2NO2(g) N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是
。
N2O4(g)達到平衡。其它條件不變時,下列措施能提高NO2轉化率的是
。
A.減小NO2的濃度 B.降低溫度 C.增加NO2的濃度 D.升高溫度
(2)25 ℃時,1.00 g N2H4(l)與足量N2O4(l)完全反應生成N2(g)和H2O(l),放出19.14 kJ的熱量。則反應2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的H = kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密閉容器中N2O4和NO2的混合氣體達到平衡時,
c(NO2) = 0.0300 mol·L-1、c(N2O4) = 0.0120 mol·L-1。
則反應2NO2(g) N2O4(g)的
N2O4(g)的
平衡常數K = 。
(4)現用一定量的Cu與足量的濃HNO3反應,制得1.00 L已達到平衡的N2O4和NO2混合氣體(17 ℃、1.01×105 Pa),理論上至少需消耗Cu 克。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com