
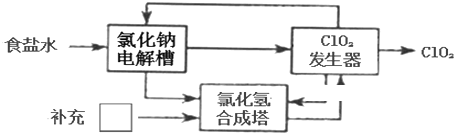
| ||
| ||


科目:高中化學 來源: 題型:
| A、NH4CNO和CO(NH2)2 |
| B、CuSO4?3H2O和CuSO4?5H2O |
C、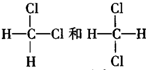 |
| D、H2O和D2O(重水) |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗步驟 | 預期現象和結論 |
步驟1:取少量吸收液于試管中,滴加3moL?L-1 H2SO4至溶液呈酸性,然后將所得溶液分置于A、B試管中. | / |
| 步驟2: | |
| 步驟3: |
查看答案和解析>>
科目:高中化學 來源: 題型:
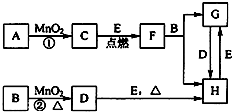 如圖中所涉及的物質均為中學化學中的常見物質,其中C為單質,且為空氣的主要成分之一;D為黃綠色氣體;E為日常生活中應用最廣泛的金屬單質之一,其余為化合物.它們存在如圖所示的轉化關系,反應中生成的次要產物均已略去.
如圖中所涉及的物質均為中學化學中的常見物質,其中C為單質,且為空氣的主要成分之一;D為黃綠色氣體;E為日常生活中應用最廣泛的金屬單質之一,其余為化合物.它們存在如圖所示的轉化關系,反應中生成的次要產物均已略去.查看答案和解析>>
科目:高中化學 來源: 題型:
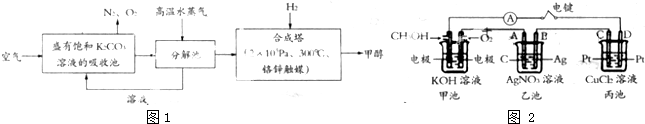
查看答案和解析>>
科目:高中化學 來源: 題型:
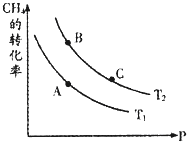 生產甲醇的原料CO、H2可由下列反應制取:CH4(g)+H2O(g)?CO(g)+3H2(g),試回答下列問題.
生產甲醇的原料CO、H2可由下列反應制取:CH4(g)+H2O(g)?CO(g)+3H2(g),試回答下列問題.| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com