
分析 (1)過氧化氫做消毒劑是利用過氧化氫的氧化性,據此分析選項中元素化合價變化判斷;
(2)依據熱化學方程式和蓋斯定律計算所需讓化學方程式,分析計算得到熱化學方程式分析熵變;
(3)先設A、B的物質的量為nmol;根據D的濃度計算D的物質的量,根據D的物質的量計算反應的A、B的物質的量,根據5min時,A、B濃度之比求出A、B開始時的物質的量,用開始時的物質的量減反應的物質的量即為5min末的物質的量,再根據物質的量濃度公式計算濃度;反應速率之比即為計量數之比;根據C的反應速率求A的反應速率.根據A的轉化濃度計算A的轉化率.
解答 解:(1)H2O2所體現的性質與其可以作為消毒劑完全一致的是,過氧化氫表現氧化性分析;
A.BaO2+2HCl$\frac{\underline{\;冰\;}}{\;}$H2O2+BaCl2,過氧化氫是反應生成物,故A錯誤;
B.Ag2O+H2O2═2Ag+O2+H2O,過氧化氫從-1價變化為0價,做還原劑,故B錯誤;
C.2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,過氧化氫自身氧化還原反應,故C錯誤;
D. H2O2+NaCrO2+NaOH═Na2CrO4+H2O,反應中過氧化氫氧元素化合價從-1價變化為-2價,反應中做氧化劑,故D正確;
故答案為:D;
(2)①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1
②H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H=-98.64kJ•mol-1
③H2O(l)=H2O(g)△H=+44kJ•mol-l
依據蓋斯定律計算①+②×2+③×2得到,反應的熱化學方程式:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-643.28KJ/mol;反應前后氣體體積增大,所以△S>0;
故答案為:-643.28KJ/mol;>;
(3)D的濃度為0.5mol/L,所以D的物質的量為1mol.
設A、B的物質的量為nmol,
3A(g)+B(g)=xC(g)+2D(g),
開始 n mol n mol 0 0
反應 1.5mol 0.5mol 1mol
5min (n-1.5)mol ( n-0.5)mol 1mol
同一容器中,c(A):c(B)=n(A):n(B)=$\frac{n-1.5}{n-0.5}$=$\frac{3}{5}$;n=3mol;
(1)D的濃度為0.5mol/L,反應時間為5min,D的反應速率為$\frac{0.5mol/L}{5min}$=0.1mol/(L•min),C的反應速率是0.1mol/(L•min),根據同一反應中,各物質的反應速率之比等于計量數之比,所以x=2,故答案為:2;
(2)C的反應速率是0.1mol/(L•min),根據同一反應中,各物質的反應速率之比等于計量數之比,所以B的反應速率是0.5×0.1mol/(L•min)=0.05mol/(L•min),
故答案為:0.05mol/(L•min);
(3)A的轉化率為:$\frac{1.5mol}{3mol}$×100%=50%,故答案為:50%.
點評 本題考查較綜合,為高考常見題型,側重考查學生的分析、計算能力,涉及氧化還原反應、化學反應速率與化學計量數的關系,根據反應物的物質的量關系運用三段式法計算平衡時的物質的量是解答該題的關鍵,注意同一反應中反應速率之比等于化學計量數之比.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 甲醛 | B. | MgSO4 | C. | NH4Cl | D. | Hg(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S2O82-離子中存在一個過氧鍵(-O-O-),則S2O82-離子中硫元素的化合價為+6 | |
| B. | 反應②若有0.1mol還原劑被氧化,則轉移電子0.5mol | |
| C. | K2S2O8與濃鹽酸混合可得到黃綠色氣體 | |
| D. | 反應①配平后還原劑與還原產物之比為8:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 區分的物質 | 區分方法 |
| A | 蒸餾水和自來水 | ①蒸發 ②看顏色 |
| B | 食鹽和面堿(Na2CO3) | ①加食醋 ②加石灰水 |
| C | 黃金和黃銅(假黃金) | ①灼燒 ②測密度 |
| D | 黑醋和醬油 | ①聞氣味 ②嘗味道 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
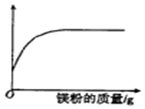
| A. | 溶液的質量 | B. | 稀鹽酸的質量 | C. | 氯化鎂的質量 | D. | 生成氣體的質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 測定0.1mol•L-1醋酸溶液的pH | |
| B. | 測定0.1 mol•L-1CH3COONa溶液的酸堿性 | |
| C. | 比較濃度均為0.1 mol•L-1鹽酸和醋酸溶液的導電能力 | |
| D. | 比較相同物質的量濃度的NaOH溶液和醋酸溶液恰好反應完全時消耗兩溶液的體積 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
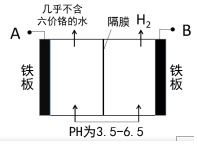 某工廠采用電解法處理含鉻廢水,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,工業設備如圖所示,下列說法不正確的是( )
某工廠采用電解法處理含鉻廢水,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,工業設備如圖所示,下列說法不正確的是( )| A. | A接電源正極 | |
| B. | 陽極區溶液中發生的氧化還原反應為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 陰極區附近溶液pH減小 | |
| D. | 若不考慮氣體的溶解,當收集到H2 13.44L時(標況),有0.1mol Cr2O72-被還原 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com