
 原子序數依次增大的A、B、C、D、E五種短周期元素,A是原子半徑最小的元素,B的單質分子中有三對共用電子,C最外層電子數是次外層電子數的3倍,A、D同主族,E原子電子數比C原子電子數多5個,請回答下列問題:
原子序數依次增大的A、B、C、D、E五種短周期元素,A是原子半徑最小的元素,B的單質分子中有三對共用電子,C最外層電子數是次外層電子數的3倍,A、D同主族,E原子電子數比C原子電子數多5個,請回答下列問題: ,以W溶液作為電解質溶液,E棒與鐵棒分別作為電極構成原電池,則負極的電極反應式Al-3e-+4OH-=AlO2-+2H2O;
,以W溶液作為電解質溶液,E棒與鐵棒分別作為電極構成原電池,則負極的電極反應式Al-3e-+4OH-=AlO2-+2H2O;分析 原子序數依次增大的A、B、C、D、E五種短周期元素,A是原子半徑最小的元素,則A為H元素;B的單質分子中有三對共用電子,則B為N元素;C最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,故C為O元素;A、D同主族,D的原子序數大于氧,故D為Na;E原子電子數比C原子電子數多5個,E原子核外電子數為13,故E為Al.
(1)A、C、D形成的化合物W為NaOH,由鈉離子與氫氧根離子構成;以NaOH溶液作為電解質溶液,Al棒與鐵棒分別作為電極構成原電池,Al作負極,Al失去電子,堿性條件下生成偏鋁酸根;
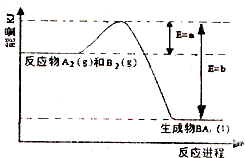
(2)①由圖可知,一定溫度和壓強下H2(g)和N2(g)反應生成1molNH3(l)過程中放出的熱量為(b-a)kJ,則:N2(g)+3H2(g)?2NH3(l)△H=-2(b-a)kJ/mol,結合已知熱化學方程式,利用蓋斯定律構造目標熱化學方程式;
②N2(g)+3H2(g)?2NH3(g)是氣體體積減小的放熱反應,增大壓強,降低溫度,平衡向正反應方向移動,氮氣轉化率增大,使用催化劑縮短到達平衡的時間,不影響平衡移動,氮氣的轉化率不變;
③25℃時,xmol/L的NH3水溶液的pH=14-n,計算溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-(14-n)}}$mol/L=10-nmol/L,電離方程式為:NH3.H2O?NH4++OH-,若忽略水的電離,則c(NH4+)≈c(OH-),溶液中c(NH3.H2O)=xmol/L-c(NH4+),則NH3水合分子的電離平衡常數Ka=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
(3)化合物甲、乙都由H、N、O三種元素組成,甲為弱堿,即甲為NH3•H2O,乙為強酸,即乙為HNO3,若硝酸溶液的pH=a,根據Kw=c(H+)•c(OH-),計算硝酸溶液中水電離產生的C(H+)=c(OH-),常溫下,若兩溶液中水的電離程度相同,則氨水溶液中氫離子濃度等于硝酸溶液中氫氧根離子濃度;
(4)用Na2O2在酸性條件下處理CN-的工業廢水,反應生成氮氣以及CO2等物質,結合守恒配平書寫離子方程式.
解答 解:原子序數依次增大的A、B、C、D、E五種短周期元素,A是原子半徑最小的元素,則A為H元素;B的單質分子中有三對共用電子,則B為N元素;C最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,故C為O元素;A、D同主族,D的原子序數大于氧,故D為Na;E原子電子數比C原子電子數多5個,E原子核外電子數為13,故E為Al.
(1)A、C、D形成的化合物W為NaOH,其電子式為 ,以NaOH溶液作為電解質溶液,Al棒與鐵棒分別作為電極構成原電池,Al作負極,則負極的電極反應式:Al-3e-+4OH-=AlO2-+2H2O,
,以NaOH溶液作為電解質溶液,Al棒與鐵棒分別作為電極構成原電池,Al作負極,則負極的電極反應式:Al-3e-+4OH-=AlO2-+2H2O,
故答案為: ;Al-3e-+4OH-=AlO2-+2H2O;
;Al-3e-+4OH-=AlO2-+2H2O;
(2)A2和B2在工業上可合成一種重要的原料BA3.
①由圖可知,一定溫度和壓強下H2(g)和N2(g)反應生成1molNH3(l)過程中放出的熱量為(b-a)kJ,
則:N2(g)+3H2(g)?2NH3(l)△H=-2(b-a)kJ/mol,①
已知:BH3(l)?BH3(g)△H=+ckJ/mol,則生成1molNH3(g) ②
根據蓋斯定律,①+②×2得:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a-c)kJ•mol-1,
故答案為:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a-c)kJ•mol-1;
②N2(g)+3H2(g)?2NH3(g)是氣體體積減小的放熱反應,
A.采取20~50MPa的大氣壓,增大壓強,平衡向正反應方向移動,氮氣轉化率增大,故A正確;
B.降低溫度,平衡向正反應方向移動,氮氣的轉化率增大,故B正確;
C.使用催化劑縮短到達平衡的時間,不影響平衡移動,氮氣的轉化率不變,故C錯誤,
故選:AB;
③25℃時,xmol/L的NH3水溶液的pH=14-n,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-(14-n)}}$mol/L=10-nmol/L,電離方程式為:NH3.H2O?NH4++OH-,若忽略水的電離,則c(NH4+)≈c(OH-)=10-nmol/L,溶液中c(NH3.H2O)=(x-10-n)mol/L,則NH3水合分子的電離平衡常數為$\frac{1{0}^{-n}×1{0}^{-n}}{x-1{0}^{-n}}$=$\frac{1{0}^{-2n}}{x-1{0}^{-n}}$,
故答案為:$\frac{1{0}^{-2n}}{x-1{0}^{-n}}$;
(3)化合物甲、乙都由H、N、O三種元素組成,甲為弱堿,即甲為NH3•H2O,乙為強酸,即乙為HNO3,若硝酸溶液的pH=a,據Kw=c(H+)•c(OH-),則溶液中水電離產生的C(H+)=c(OH-)=10a-14mol/L,常溫下,若兩溶液中水的電離程度相同,則甲溶液中水電離產生的c(H+)=10a-14mol/L,
故答案為:10a-14mol/L;
(4)用Na2O2在酸性條件下處理CN-的工業廢水,將得到一種能夠參與大氣生態環境循環的氣體以及CO2等物質,參與大氣生態環境循環的氣體為氮氣,該反應的離子方程式:5Na2O2+2CN-+12H+=2CO2↑+N2↑+10Na++6H2O,
故答案為:5Na2O2+2CN-+12H+=2CO2↑+N2↑+10Na++6H2O.
點評 本題考查結構性質位置關系綜合應用,涉及電子式、電極反應式、熱化學方程式、化學平衡移動、弱電解質的電離計算、離子方程式書寫等,是對基礎知識的綜合考查,難度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加入氫氧化鈉溶液,加熱試管,再滴入酚酞試液 | |
| B. | 加入氫氧化鈉溶液,加熱試管,并用濕潤的紅色石蕊試紙接近試管口上方 | |
| C. | 加熱試管,并用濕潤的紅色石蕊試紙接近試管口上方 | |
| D. | 加水溶解,再用紅色石蕊試紙檢驗其溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na、Mg、Al還原性依次增強 | B. | HClO4、HIO4、HBrO4酸性依次減弱 | ||
| C. | KOH、NaOH、LiOH堿性依次減弱 | D. | S、Na、O原子半徑依次減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氟氯烴的大量排放是造成酸雨的主要原因 | |
| B. | 等質量的同種煤粉和煤塊完全燃燒,放出熱量前者大于后者 | |
| C. | 液氯泄漏事故發生時,周邊的人應該朝順風方向逃逸或向避風的溝塘低洼處轉移 | |
| D. | 火箭發動機有偏二甲肼(C2H8N2)與N2O4混合后充分燃燒,可生成CO2、N2和H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2mol•L-1醋酸溶液和0.2mol•L-1醋酸鈉溶液等體積混合:C(CH3COOH)+C(H+)-C(OH-)=0.1mol•L-1 | |
| B. | pH相等的①(NH4)2SO4②NH4HSO4③NH4Cl溶液:c(NH4+)大小順序為:①>②>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中c(Na+)+c (H+)=C (CO32-)+c(HCO3-)+c(OH-) | |
| D. | 0.1mol•L-1的NaHB溶液,其中PH=4:c(HB-)>c(H+)>c(H2B)>c(B2-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應后的固體混合物中還含有碳 | |
| B. | 反應后的固體混合物總質量為12.8 g | |
| C. | 反應后的固體混合物中氧化物的物質的量為0.05 mol | |
| D. | 反應后的固體混合物中單質Cu的質量為12.8 g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某課外小組的同學擬用廢鋁箔制取硫酸鋁晶體,已知鋁的物種類別與溶液pH關系如圖所示,實驗中可選用的試劑:處理過的鋁箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸
某課外小組的同學擬用廢鋁箔制取硫酸鋁晶體,已知鋁的物種類別與溶液pH關系如圖所示,實驗中可選用的試劑:處理過的鋁箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用太陽能等清潔能源代替化石燃料,有利于節約資源、保護環境 | |
| B. | 大量使用化肥和農藥,以提高農作物產量 | |
| C. | 不隨意丟棄舊電池,生活垃圾分類放置 | |
| D. | “綠色化學”的核心是使原料盡可能全部轉化為目標產物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com