
某混合金屬粉末,除Mg外還含有Al、Zn中的一種或兩種,含量都在10%以上。某研究小組設計實驗探究該混合金屬粉末中鋁、鋅元素的存在。
所用試劑:樣品、pH試紙、稀H2SO4、NaOH溶液、稀NH3·H2O。
該小組探究過程如下:
●查閱資料:
|
①鎂、鋁、鋅都是銀白色的金屬 ②鋅(Zn)可以與NaOH溶液反應生成H2 ③Zn(OH)2為白色固體,難溶于水,可溶于強堿及NH3·H2O ④Zn2+易形成絡合物如[Zn(NH3)4]2+,該絡合物遇強酸分解生成Zn2+、NH4+ |
●提出假設:
(1)假設①:該混合金屬粉末中除鎂外還含有鋁元素;
假設②:該混合金屬粉末中除鎂外還含有鋅元素;
假設③: 。
●實驗探究:
甲同學基于假設③設計實驗方案如下:

乙同學同樣基于假設3設計另一實驗方案如下:

(2)試劑M是________________;沉淀B是 。
(3)丙同學認為乙同學的方案比甲同學的好,理由是 。
(4)丁同學研究了甲、乙兩同學的方案后,在其中一種方案的基礎上用最簡便方法測定了Wg樣品中金屬鎂(Mg)的質量,他的方法是 。
(5)操作Ⅰ的主要過程是:在濾液中逐滴加入 ,直至生成的沉淀剛好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等離子,向其中逐滴加入NaOH溶液,則生成沉淀的物質的量與加入NaOH溶液體積關系的圖像正確的是__________。
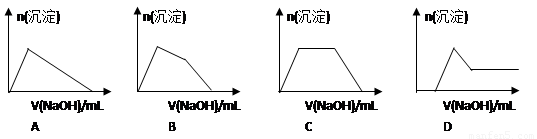
(1)該混合金屬粉末中除鎂外還含有鋁、鋅元素 (2)NaOH溶液;Al(OH)3
(3)步驟簡單,節約試劑;(4)將沉淀C洗滌、小心干燥后稱量;(5)稀硫酸;稀氨水;(6)B
【解析】
試題分析:(1)由于混合金屬粉末,除Mg外還含有Al、Zn中的一種或兩種,實驗根據假設①②可知,假設③應該是該混合金屬粉末中除鎂外還含有鋁、鋅元素。
(2)樣品與稀硫酸反應生成相應的硫酸鹽。由于氫氧化鋅、氫氧化鋁均能和氫氧化鈉溶液反應,所以首先加入過量的氫氧化鈉溶液得到氫氧化鎂沉淀,而鋅離子和鋁離子分別是生成相應的偏鋁酸鹽,即M是氫氧化鈉溶液,沉淀A是氫氧化鎂。由于Zn(OH)2為白色固體,難溶于水,可溶于強堿及NH3·H2O,但氫氧化鋁不能溶于氨水中,所以可以向濾液中先加入酸將偏鋁酸鹽轉化為鋅離子和鋁離子,然后加入過量的氨水得到氫氧化鋁白色沉淀,而鋅離子轉化為[Zn(NH3)4]2+,所以沉淀B是氫氧化鋁。由于Zn2+易形成絡合物如[Zn(NH3)4]2+,該絡合物遇強酸分解生成Zn2+、NH4+,所以向濾液中加入稀硫酸即可生成Zn2+、NH4+,最后加入適量的氫氧化鈉溶液生成氫氧化鋅沉淀。
(3)由于鋅(Zn)、鋁均可以與NaOH溶液反應生成H2,所以在乙方案中首先加入過量的氫氧化鈉溶液,將鋅和鋁溶解,而鎂不溶解,即沉淀C是鎂。而后續的操作與甲方案是相同的,所以乙同學的方案比甲同學的好,理由是步驟簡單,節約試劑。
(4)由于在乙方案中沉淀C就是鎂,所以只需要將沉淀C洗滌、小心干燥后稱量即可得出鎂的含量。
(5)根據以上分析可知,操作Ⅰ的主要過程是:在濾液中逐滴加入稀硫酸,直至生成的沉淀剛好溶解,最后再加入足量的氨水即可生成氫氧化鋁白色沉淀。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等離子,向其中逐滴加入NaOH溶液,則首先生成氫氧化鋅、氫氧化鋁沉淀。由于氫氧化鋅能溶解在氨水中,所以加入的氫氧化鈉首先溶解氫氧化鋅,然后氫氧化鈉再與溶液中的NH4+反應,最后加入的氫氧化鈉再和氫氧化鋁反應而使其溶解,因此生成沉淀的物質的量與加入NaOH溶液體積關系的圖像正確的是B。
考點:考查實驗方案設計與評價;物質的分離與提純;以及沉淀生成與溶解的圖像分析與判斷


 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:閱讀理解
| ①鎂、鋁、鋅都是銀白色的金屬 ②鋅(Zn)可以與NaOH溶液反應生成H2 ③Zn(OH)2為白色固體,難溶于水,可溶于強堿及NH3?H2O ④Zn2+易形成絡合物如[Zn(NH3)4]2+,該絡合物遇強酸分解生成Zn2+、NH4+●提出假設: (1)假設①:該混合金屬粉末中除鎂外還含有 Al Al 元素假設②:該混合金屬粉末中除鎂外還含有 Zn Zn 元素假設③:該混合金屬粉末中除鎂外還含有鋁、鋅元素 ●實驗探究: 甲同學基于假設③設計實驗方案如下:乙同學同樣基于假設③設計另一實驗方案如下: 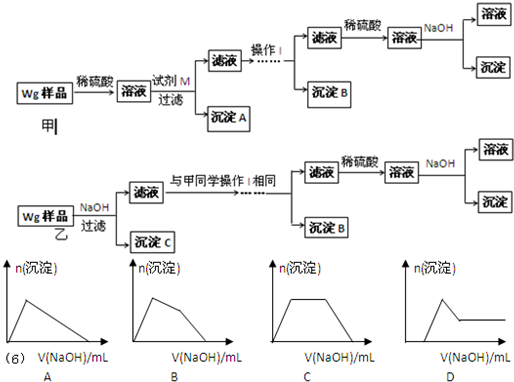 (2)試劑M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同學認為乙同學的方案比甲同學的好,理由是 步驟簡單,節約試劑 步驟簡單,節約試劑 .(4)丁同學研究了甲、乙兩同學的方案后,在其中一種方案的基礎上用最簡便方法測定了Wg樣品中金屬鎂(Mg)的質量,他的方法是 將沉淀C洗滌、小心干燥后稱量 將沉淀C洗滌、小心干燥后稱量 .(5)操作Ⅰ的主要過程是:在濾液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀剛好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等離子,向其中逐滴加入NaOH溶液,則生成沉淀的物質的量與加入NaOH溶液體積關系的圖象正確的是 B B .
查看答案和解析>> 科目:高中化學 來源: 題型: 某混合金屬粉末,除Mg外,還含有Al、Zn中的一種或兩種,含量都在 10%以上。某研究小組設計實驗探究該混合金屬粉末中鋁、鋅元素的存在。 所用試劑:樣品、pH試紙、稀H2SO4、NaOH溶液、稀NH3·H2O。 該小組探究過程如下: ● 查閱資料:
● 提出假設: (1)假設①:該混合金屬粉末中除鎂外還含有________元素 假設②:該混合金屬粉末中除鎂外還含有________元素 假設③:該混合金屬粉末中除鎂外還含有鋁、鋅元素 ● 實驗探究: 甲同學基于假設③設計實驗方案如下: 乙同學同樣基于假設3設計另一實驗方案如下: (2)試劑M是________________;沉淀B是 。 (3)丙同學認為乙同學的方案比甲同學的好,理由是 。 (4)丁同學研究了甲、乙兩同學的方案后,在其中一種方案的基礎上用最簡便方法測定了Wg樣品中金屬鎂(Mg)的質量,他的方法是 。 (5)操作Ⅰ的主要過程是:在濾液中逐滴加入 ,直至生成的沉淀剛好溶解,再加入足量的 。 (6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等離子,向其中逐滴加入NaOH溶液, 則生成沉淀的物質的量與加入NaOH溶液體積關系的圖像正確的是__________。
查看答案和解析>> 科目:高中化學 來源:2012屆上海市閔行區高三上學期期末質量抽測化學試卷 題型:填空題 某混合金屬粉末,除Mg外,還含有Al、Zn中的一種或兩種,含量都在10%以上。某研究小組設計實驗探究該混合金屬粉末中鋁、鋅元素的存在。所用試劑:樣品、pH試紙、稀H2SO4、NaOH溶液、稀NH3·H2O。
查看答案和解析>> 科目:高中化學 來源:2013-2014學年黑龍江省高三上學期第三次驗收考試化學試卷(解析版) 題型:實驗題 某混合金屬粉末,除Fe外,還含有Al、Zn中的一種或兩種,含量都在10%以上。某研究小組設計實驗探究該混合金屬粉末中鋁、鋅元素的存在,探究過程如下: 【查閱資料】①Zn可以與NaOH溶液反應生成H2 ②Zn(OH)2為白色固體,難溶于水,可溶于強堿及NH3·H2O ③Zn2+易形成絡合物如[Zn(NH3)4]2+,該絡合物遇強酸生成Zn2+、NH4+ 【提出假設】假設①:該混合金屬粉末中除Fe外還含有Al元素 假設②:該混合金屬粉末中除Fe外還含有Zn元素 假設③:該混合金屬粉末中除Fe外還含有Al、Zn元素 【實驗探究】所用試劑:樣品、pH試紙、稀H2SO4、NaOH溶液、稀NH3·H2O。 甲同學基于假設③設計實驗方案如下:
乙同學同樣基于假設③設計另一實驗方案如下:
(1)Fe元素在周期表中的位置是第 周期 族。 (2)試劑M是 ;沉淀B是 。 (3)你認為甲、乙同學的方案 (填“甲”或“乙”)比較好,理由是 。 (4)操作Ⅰ的主要過程是:在濾液中逐滴加入 ,直至生成的沉淀剛好溶解,再加入足量的 。 (5)乙同學將沉淀C洗滌、烘干、冷卻后稱重,質量為m1g,經計算即可得到樣品中鐵的質量分數,你認為 (填“是”或“否”)準確,原因是 。 (6)電解法制金屬鋁的化學方程式是 。 以Al和NiO(OH)為電極,NaOH溶液為電解液組成一種新型電池,放電時NiO(OH)轉化為Ni(OH)2,該電池反應的化學方程式是 。
查看答案和解析>> 同步練習冊答案 湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區 違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com版權聲明:本站所有文章,圖片來源于網絡,著作權及版權歸原作者所有,轉載無意侵犯版權,如有侵權,請作者速來函告知,我們將盡快處理,聯系qq:3310059649。 ICP備案序號: 滬ICP備07509807號-10 鄂公網安備42018502000812號 |