
| A. | C2H6O | B. | C3H8O | C. | C4H10O | D. | C5H12O |
分析 根據醇的氧化規律:當與羥基連的碳原子上連有2個H原子時,催化氧化產物為醛,據此分析判斷.
解答 解:A、C2H6O催化氧化產物為乙醛,只有一種結構,故A不選;
B、C3H8O催化氧化產物為丙醛或丙酮,故B選;
C、C4H10O催化氧化產物中有1-丁醛和2-甲基丙醛,所以C4H10O最多可被空氣中的氧氣氧化成兩種不同的醛,故C選;
D、C5H12O催化氧化產物中有1-戊醛、2-甲基丁醛、3-甲基丁醛、2,2-二甲基丙醛,所以C5H12O最多可被空氣中的氧氣氧化成四種不同的醛,故D不選;
故選B.
點評 本題考查同分異構體的應用和醇的氧化等知識,側重于對醇的氧化規律的考查,難度中等,注意對知識的歸納整理.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.
碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.| 時間/min 濃度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷是最簡單的烴,其含碳量最高 | |
| B. | 烷烴完全燃燒時,生成CO2和H2O的物質的量相等 | |
| C. | 苯不能與氫氣加成,說明苯不具備單雙建交替結構 | |
| D. | 任何烯烴完全燃燒時,生成CO2和H2O的物質的量相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
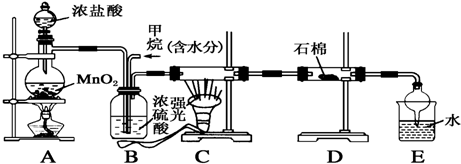
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖②中曲線表示反應2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反應的平衡常數K隨溫度的變化 | |
| B. | 圖①表示25℃時,用0.1mol•L-1鹽酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH隨加入酸體積的變化 | |
| C. | 圖③表示10mL 0.01mol•L-1 KMnO4 酸性溶液與過量的0.1mol•L-1 H2C2O4溶液混合時,n(Mn2+) 隨時間的變化 | |
| D. | 圖④中a、b曲線分別表示反應CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化劑時,反應過程中的能量變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com