
| A. | 在飽和AgCl,AgBr的混合溶液中:$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=360 | |
| B. | 向AgCl懸濁液中滴加NaBr溶液會產生淡黃色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 欲用1L NaCl溶液將0.01 mol AgBr轉化為AgCl,則c(NaCl)>3.61 mol/L |
分析 A.根據AgCl,AgBr的Ksp計算;
B.溶度積大的沉淀容易轉化為溶度積小的沉淀;
C.溶解度與Ksp均只與溫度有關;
D.用1L NaCl溶液將0.01 mol AgBr轉化為AgCl,則溶液中Br-濃度變為0.01mol/L,根據Ksp(AgBr)計算銀離子的濃度,再根據Ksp(AgCl)計算c(Cl-).
解答 解:A.已知常溫下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,在飽和AgCl,AgBr的混合溶液中:$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$=360,故A正確;
B.已知Ksp(AgCl)>Ksp(AgBr),溶度積大的沉淀容易轉化為溶度積小的沉淀,所以向AgCl懸濁液中滴加NaBr溶液會產生淡黃色AgBr沉淀,故B正確;
C.溶解度與Ksp均只與溫度有關,AgCl在水中溶解度及Ksp均與在NaCl溶液中的相同,故C錯誤;
D.用1L NaCl溶液將0.01 mol AgBr轉化為AgCl,則溶液中Br-濃度變為0.01mol/L,則c(Ag+)=$\frac{Ksp(AgBr)}{c(B{r}^{-})}$=$\frac{5×1{0}^{-13}}{0.01}$=5×10-11mol/L,則c(Cl-)=$\frac{1.8×1{0}^{-10}}{5×1{0}^{-11}}$=3.6 mol/L,所以c(NaCl)>3.61 mol/L,故D正確.
故選C.
點評 本題考查難溶電解質的溶解平衡及沉淀轉化的本質,題目難度中等,本題注意溶度積常數的利用和理解,側重于考查學生的分析能力和計算能力.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:選擇題
| 物質 | X | Y | Z |
| 初始濃度/mol/L | 0.1 | 0.2 | 0 |
| 平衡濃度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min內,用Y的變化量表示的平均反應速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反應達到平衡時,X的轉化率為50% | |
| C. | 增大壓強使平衡向生成Z的方向移動,平衡常數增大 | |
| D. | 反應可表示為X+3Y?2Z,其平衡常數為1600 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{62}^{144}$Sm與${\;}_{62}^{150}$Sm互為同位素 | |
| B. | 氯氣能使潮濕的藍布條變為白色,說明氯氣有漂白性 | |
| C. | 將1體積c1mol/L的硫酸用水稀釋為5體積,稀溶液的濃度為0.2c1mol/L | |
| D. | 焰色反應發生的是物理變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
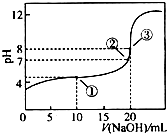 在25℃時,向50.00mL未知濃度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定過程中,溶液的pH與滴入NaOH溶液體積的關系如圖所示,則下列說法中,不正確的是( )
在25℃時,向50.00mL未知濃度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定過程中,溶液的pH與滴入NaOH溶液體積的關系如圖所示,則下列說法中,不正確的是( )| A. | 該滴定過程可采用酚酞做指示劑 | |
| B. | 圖中點③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 圖中點①所示溶液中水的電離程度大于點③所示溶液中水的電離程度 | |
| D. | 滴定過程中的某點,會有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的關系存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等質量Na2CO3 和NaHCO3分別和足量鹽酸反應,相同條件下前者生成CO2少 | |
| B. | 將石灰水分別加入NaHCO3和Na2CO3 中,前者不生成沉淀 | |
| C. | 相同條件下Na2CO3 比NaHCO3更易溶于水 | |
| D. | Na2CO3 固體中含少量NaHCO3,可用加熱法除去 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高純度的單晶硅用于制造光導纖維 | |
| B. | 從海水中提取物質都必須通過化學反應才能實現 | |
| C. | 乙酸乙酯在堿性條件下水解稱為皂化反應 | |
| D. | 可溶性銅鹽有毒,在生命體中銅是一種不可缺少的微量元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
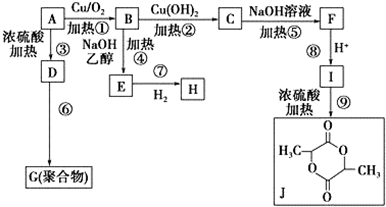
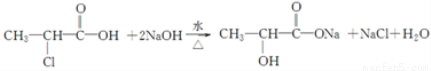 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com