
室溫下,用0.100mol·L-1 NaOH溶液分別滴定20.00ml 0.100mol·L-1 的鹽酸和醋酸,滴定曲線如圖所示,下列說法正確的是( )
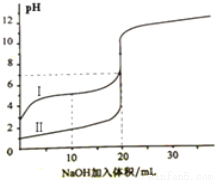
A. Ⅰ表示的是滴定鹽酸的曲線
B.PH=7時,滴定醋酸消耗V(NaOH)小于20ml
C.V(NaOH) =20ml時,兩份溶液中C(Cl—)== C(CH3COO—)
D.V(NaOH) =10ml時,醋酸溶液中:C(Na+ )> C(CH3COO—)> C(H+ )> C(OH—)
科目:高中化學 來源:2017屆陜西省安康市高三上學期第一次月考化學試卷(解析版) 題型:實驗題
為了將混有K2SO4、MgSO4的KNO3固體提純,并制得純凈的KNO3溶液,某學生設計如下實驗方案:
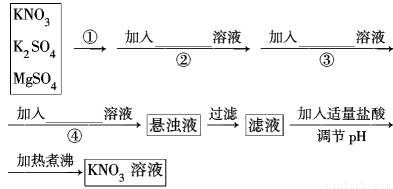
(1)操作①為_________________________。
(2)操作②~④加入的試劑依次可以為:______________________________
(3)如何判斷SO42-已除盡? _
(4)實驗過程中產生的多次沉淀________(填“需要”或“不需要”)多次過濾,其理由是______________
(5)該同學的實驗設計方案是否嚴密?請說明理由:____________________。
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上學期暑假聯考化學試卷(解析版) 題型:填空題
我國產銅主要取自黃銅礦(CuFeS2),隨著礦石品味的降低和環保要求的提高,濕法煉銅的優勢日益突出。該工藝的核心是黃銅礦的浸出,目前主要有氧化浸出、配位浸出和生物浸出三種方法。
I.氧化浸出
(1)在硫酸介質中用雙氧水將黃銅礦氧化,測得有SO42-生成。
①該反應的離子方程式為 。
②該反應在25—50℃下進行,實際生產中雙氧水的消耗量要遠遠高于理論值,試分析其原因為 。
Ⅱ.配位浸出
反應原理為: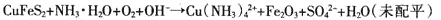
(2)為提高黃銅礦的浸出率,可采取的措施有 (至少寫出兩點)。
(3)為穩定浸出液的pH,生產中需要向氨水中添加NH4C1,構成NH3·H2O-NH4Cl緩沖溶液。某小組在實驗室對該緩沖體系進行了研究:25℃時,向amol·L-l的氨水中緩慢加入等體積0.02 mol·L-l的NH4C1溶液,平衡時溶液呈中性。則NH3·H2O的電離常數Kb= (用含a的代數式表示);滴加NH4C1溶液的過程中水的電離平衡 (填“正向”、“逆向”或“不”)移動。
Ⅲ.生物浸出
在反應釜中加入黃銅礦、硫酸鐵、硫酸和微生物,并鼓入空氣,黃銅礦逐漸溶解,反應釜中各物質的轉化關系如圖所示。
(4)在微生物的作用下,可以循環使用的物質有 (填化學式),微生物參與的離子反應方程式為____ (任寫一個)。
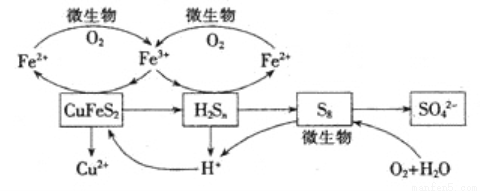
(5)假如黃銅礦中的鐵元素最終全部轉化為Fe3+,當有2 mol SO42-生成時,理論上消耗O2的物質的量為_____________。
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上學期暑假聯考化學試卷(解析版) 題型:選擇題
除去下列物質中所含的雜質,選用的試劑正確的是
選項 | 物質(雜質) | 試劑 |
A | Al2O3(SiO2) | NaOH溶液 |
B | FeCl2溶液(FeCl3) | Fe粉 |
C | CO2(SO2) | Na2CO3溶液 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化學 來源:2017屆江西省南五校高三上學期第一次模擬考試化學試卷(解析版) 題型:填空題
為有效控制霧霾,各地積極采取措施改善大氣質量。有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要。
(1)在汽車排氣管內安裝催化轉化器,可將汽車尾氣中主要污染物轉化為無毒的大氣循環物質。
已知:① N2(g) + O2(g)  2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃燒熱(△H)分別為-393.5 kJ·mol-1和-283 kJ·mol-1
則2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的△H=_____kJ·mol-1
N2(g) + 2CO2(g)的△H=_____kJ·mol-1
(2)將0.20 mol NO和0.10 mol CO充入一個容積為1L的密閉容器中,反應過程中物質濃度變化如圖所示。
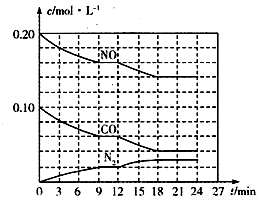
①CO在0-9min內的平均反應速率v(CO)=________mol·L-1·min-1(保留兩位有效數字);第12 min時改變的反應條件可能為________。
A.升高溫度 B.加入NO C.加催化劑 D.降低溫度
②該反應在第24 min時達到平衡狀態,CO2的體積分數為________(保留三位有效數字),化學平衡常數值為________(保留兩位有效數字)。
(3)煙氣中的SO2可用某濃度NaOH溶液吸收,若將一定量的SO2氣體通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀鹽酸至過量,產生的氣體與反應的HCl兩者物質的量的關系如圖所示(氣體的溶解和HCl的揮發忽略,NaHSO3水溶液為酸性):
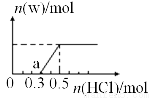
①O點溶液中所含溶質的化學式為_________________;
②a點溶液中各離子溶度大小關系為______________;
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省汕頭市高三上學期入學考理綜化學試卷(解析版) 題型:推斷題
有機物A(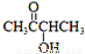 )有如下轉化關系,且 1mol B反應生成了2mol C。
)有如下轉化關系,且 1mol B反應生成了2mol C。
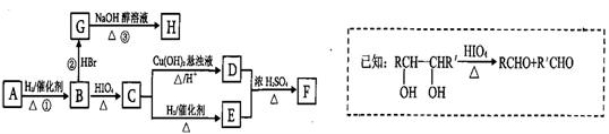
請回答下列問題:(1)C→E的反應類型為_______________________ 。
(2)若①、②、③三步反應的產率分別為93.0%、81.0%、88.09%,則由A合成H的總產率為________。
(3)F的名稱為
(4)寫出C與銀氨溶液反應的離子方程式為______ _________。
(5)H分子中所有碳原子均在一條直線上,G轉化為H的化學方程式為:________________ 。
(6)X是A的一種同分異構體,且其核磁共振氫譜有3個峰,峰面積之比為1:1:2,1mol X可在HIO4加熱的條件下反應,產物只有1mol Y,則X的結構簡式為_________________________.
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省汕頭市高三上學期入學考理綜化學試卷(解析版) 題型:選擇題
在常溫下,發生下列幾種反應:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
Cl2 + 2NaBr = 2NaCl + Br2 Br2 + 2FeBr2 = 2FeBr3
根據上述反應,下列結論正確的是( )
A.還原性強弱順序為:Br—>Fe2+>Cl—
B.氧化性強弱順序為:MnO4—>Cl2>Br2>Fe3+
C.反應·中,當生成1molCl2 時,被氧化的HCl為3.2mol
D.溶液中可發生反應:2Fe3+ + 2Cl— = 2Fe2+ + Cl2↑
查看答案和解析>>
科目:高中化學 來源:2015-2016學年新疆石河子二中高二(下)期末化學試卷(解析版) 題型:實驗題
氫化阿托醛(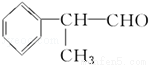 )是一種重要的化工原料,其合成路線如下:
)是一種重要的化工原料,其合成路線如下:
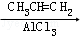

 [A]
[A]
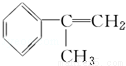

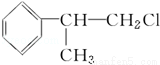
 [D](Mr=136)
[D](Mr=136)
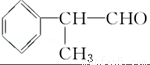
(1)在合成路線上①~⑤反應中,屬于消去反應的為 (填反應序號).
(2)寫出反應③、④的化學方程式: .
(3)在一定條件下,D與有機物X發生酯化反應生成E(Mr=164),則X的結構簡式為 ,
寫出滿足下述兩個條件的E的兩種同分異構體的結構簡式: .
a.屬于羧酸 b.苯環上的一氯取代物只有一種結構.
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省高二(下)期末化學試卷(解析版) 題型:選擇題
下列敘述正確的是( )
A.Cl2+2Br﹣═2Cl﹣+Br2、Zn+Cu2+═Zn2++Cu均為單質被還原的置換反應
B.2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均為水作還原劑的氧化還原反應
C.Cl元素的單質在化學反應中只表現氧化性
D.NaSO3與H2O2的反應為氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com