
【題目】“低碳經濟”已成為全世界科學家研究的重要課題,其綜合利用具有重要意義。回答下列問題:
(1)CO2與CH4經催化重整,制得合成氣:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反應中相關的化學鍵鍵能數據如下:
化學鍵 | C—H | C=O | H—H | C |
鍵能/kJ·mol1 | 413 | 745 | 436 | 1075 |
則該反應的ΔH=_________。有利于提高CH4平衡轉化率的條件是____(填標號)。
A.高溫低壓 B.低溫高壓 C.高溫高壓 D.低溫低壓
②某溫度下,在體積為2 L的容器中加入2 mol CH4、1 mol CO2以及催化劑進行重整反應,達到平衡時CO2的轉化率是50%,其平衡常數為_______mol2·L-2。
(2)CO2可以被NaOH溶液捕獲。若所得溶液c(HCO3)∶c(CO32 -)=2∶1,溶液pH=____。(室溫下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中陰離子的濃度由大到小的順序為______________
(3)研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應發生在_______極,該電極反應式是___________________________________
【答案】+120 kJ·mol–1 A ![]() 10 HCO3>OH> CO32 - 陰 CO2+6H++6e-=CH3OH+H2O
10 HCO3>OH> CO32 - 陰 CO2+6H++6e-=CH3OH+H2O
【解析】
(1)①該反應的△H=反應物總鍵能-生成物總鍵能;CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)為氣體體積增大的吸熱反應,高溫低壓利于平衡正向移動。
2CO (g)+ 2H2(g)為氣體體積增大的吸熱反應,高溫低壓利于平衡正向移動。
②達到平衡時CO2的轉化率是50%,根據方程式知,參加反應的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol,
該化學反應 CH4(g) + CO2(g) ![]() 2CO(g)+ 2H2(g),
2CO(g)+ 2H2(g),
開始(mol·L-1)1 0.5 0 0
反應(mol·L-1)0.25 0.25 0.5 0.5
平衡(mol·L-1)0.75 0.25 0.5 0.5
化學平衡常數K=c2(CO)·c2(H2)/[c(CH4)·c(CO2)];
(2)所得溶液c(HCO3-):c(CO32-)=2:1,根據K2=c(CO32-)·c(H+)/c(HCO3-)=5×10-11,計算c(H+),進而計算溶液pH。
碳酸氫根離子水解生成碳酸分子和氫氧根離子,碳酸氫根離子的水解程度大于電離程度;
(3)CO2也可在酸性水溶液中通過電解生成甲醇,應為電解池的陰極反應,被還原生成甲醇,據此寫出電極反應式.
(1)①該反應的△H=反應物總鍵能-生成物總鍵能=[4×413+2×745-2×1075-2×436]kJ·mol-1=+120kJ·mol-1;
CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)為氣體體積增大的吸熱反應,提高CH4平衡轉化率的條件是高溫低壓,故選A。
2CO (g)+ 2H2(g)為氣體體積增大的吸熱反應,提高CH4平衡轉化率的條件是高溫低壓,故選A。
②達到平衡時CO2的轉化率是50%,根據方程式知,參加反應的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol,
該化學反應 CH4(g) + CO2(g) ═ 2CO(g)+ 2H2(g),
開始(mol·L-1)1 0.5 0 0
反應(mol·L-1)0.25 0.25 0.5 0.5
平衡(mol·L-1)0.75 0.25 0.5 0.5
化學平衡常數K=c2(CO)·c2(H2)/[c(CH4)·c(CO2)]=0.52×0.52÷(0.75×0.25)=1/3;
(2)所得溶液c(HCO3-):c(CO32-)=2:1,根據K2=c(CO32-)·c(H+)/c(HCO3-)=5×10-11,可知c(H+)=1×10-10,故pH=10,
碳酸氫根離子水解生成碳酸分子和氫氧根離子,水解離子方程式為:HCO3-+H2O![]() H2CO3+OH-;HCO3-的水解常數=c(H2CO3)·c(OH-)/c(HCO3-)=c(H2CO3)·c(OH-)c(H+)/[c(HCO3-)·c(H+)]=Kw/K1=10-14÷(4×10-7)=2.5×10-8>K2=5×10-11,HCO3-水解程度大于其電離程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氫氧根來源于水的電離與HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),陰離子的濃度由大到小的順序為:c(HCO3-)>c(OH-)>c(CO32-);
H2CO3+OH-;HCO3-的水解常數=c(H2CO3)·c(OH-)/c(HCO3-)=c(H2CO3)·c(OH-)c(H+)/[c(HCO3-)·c(H+)]=Kw/K1=10-14÷(4×10-7)=2.5×10-8>K2=5×10-11,HCO3-水解程度大于其電離程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氫氧根來源于水的電離與HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),陰離子的濃度由大到小的順序為:c(HCO3-)>c(OH-)>c(CO32-);
(3)CO2也可在酸性水溶液中通過電解生成甲醇,C元素化合價降低,被還原,應為電解池的陰極反應,電極方程式為CO2+6H++6e-=CH3OH+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】氫氣是一種清潔能源,氫氣的制取與儲存是氫能源利用領域的研究熱點。
(1)已知:CH4(g) + H2O(g)=CO(g) +3H2(g) △H=+206.2 kJ/mol
CH4(g) + CO2(g)=2CO(g) +2H2(g) △H=+247.4 kJ/mol
2H2S(g)=2H2(g) +S2(g) △H=+169.8 kJ/mol
以甲烷為原料制取氫氣是工業上常用的制氫方法。CH4(g)與H2O(g)反應生成CO2(g)和H2(g)的熱化學方程式為________________________________。
(2)①H2S熱分解制氫時,常向反應器中通入一定比例空氣,使部分H2S燃燒,其目的是_________________________________。
②燃燒生成的SO2與H2S進一步反應,生成物在常溫下均非氣體,寫出該反應的化學方程式________________________________。
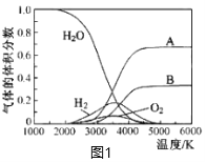
(3)H2O的熱分解也可得到H2,高溫下水分解體系中主要氣體的體積分數與溫度的關系如圖1所示。圖中A、B表示的物質依次是_________________。
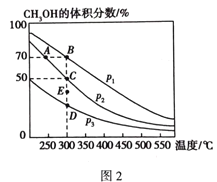
(4)將1 molCO和2 molH2充入恒容密閉容器中,在催化劑作用下發生如下反應:CO(g) + 2H2(g)![]() CH3OH(g),不同壓強下CH3OH在平衡混合氣體中的體積分數隨溫度的變化如圖2所示。A、B、C三點的化學平衡常數K(A)、K(B)、K(C)的相對大小為_______________,計算C點的壓強平衡常數Kp=___________(用平衡分壓代替平衡濃度計算,分壓=總壓×體積分數)。
CH3OH(g),不同壓強下CH3OH在平衡混合氣體中的體積分數隨溫度的變化如圖2所示。A、B、C三點的化學平衡常數K(A)、K(B)、K(C)的相對大小為_______________,計算C點的壓強平衡常數Kp=___________(用平衡分壓代替平衡濃度計算,分壓=總壓×體積分數)。
(5)Mg2Cu是一種儲氫合金。350 ℃時,Mg2Cu與H2反應,生成MgCu2和僅含一種金屬元素的氫化物(其中氫的質量分數為0.077)。Mg2Cu與H2反應的化學方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,CaCO3在水中的溶解平街曲線如陽所示。已知25℃其濃度積為2.8×10-9mol2/L2,下列說法不正的是( )
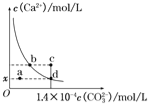
A. x數值為2×10-5 B. c點時有碳酸鈣沉淀生成
C. 加入蒸餾水可使溶液由d 點變到a點 D. b點與d對應的的溶度積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素 W、X、Y、Z 的原子序數依次增大,W 在大氣中有兩種同素異形體且均能支持燃燒,X 單質能在 Z2 氣體中燃燒,發出黃色火焰,Y 在同周期非金屬元素中原子半徑最大。下列敘述正確的是
A.Y 單質的熔點低于 X 單質
B.Z 的含氧酸均為弱酸
C.Y、Z 的單質都能在 W2 氣體中燃燒
D.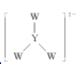 中 W 和 Y 都滿足 8 電子穩定結構
中 W 和 Y 都滿足 8 電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列表示對應化學反應的離子方程式正確的是( )
A. 漂白粉露置在空氣中失效:ClO-+CO2+H2O=HClO+HCO3-
B. 向滴有酚酞的硅酸鈉溶液中邊加邊振蕩地滴加鹽酸至紅色變淺并接近消失:2H++SiO32-=H2SiO3(膠體)
C. 惰性電極電解氯化鎂溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 在強堿溶液中次氯酸鈉與Fe(OH)3反應生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴的結構簡式為![]() ,下列對它的描述正確的是( )
,下列對它的描述正確的是( )
A. 它能使溴水褪色,但不能使酸性高錳酸鉀溶液褪色
B. 所有原子可能共平面
C. 易溶于水,也易溶于有機溶劑
D. 能發生加成反應,一定條件下最多可與三倍物質的量的氫氣加成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是人類最早使用的金屬,在生產生活中應用及其廣泛。工業上以黃銅礦 (主要成分FeCuS2)為原料制取金屬銅,其主要工藝流程如圖所示。
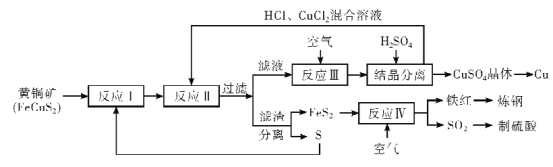
已知:反應II的離子方程式:Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列問題:
(1)FeCuS2中S的化合價____。
(2)反應I在隔絕空氣、高溫煅燒條件下進行,寫出化學方程式____。
(3)為了反應I充分進行,工業上可采取的措施是____。
(4)反應III的離子方程式為____。
(5)向反應III后的溶液中加入稀硫酸的目的是____。
(6)該流程中,可循環利用的物質除CuCl2外,還有___(填化學式)。
(7)反應IV中,處理尾氣SO2的方法,合理的是_____
A.高空排放
B.用BaCl2溶液吸收制備BaSO3
C.用氨水吸收后,再經氧化,制備(NH4)2SO4
D.用純堿溶液吸收可生成Na2SO3(H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;H2SO3:Ka1=1.2×102,Ka2=5.6×108)
(8)CuCl懸濁液中加入Na2S,發生的反應為2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq)
Cu2S(s)+2Cl-(aq)
該反應的平衡常數K=___[已知Ksp(CuCl)=a,Ksp(Cu2S)=b]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有KOH和Ca(OH)2的混合溶液,pH=13。取此溶液500mL,向其中通入CO2,通入CO2的體積(V)和生成沉淀的物質的量(n)的關系如圖所示。圖中(V1)為112mL(標準狀況),則圖中V2、V3的體積(單位為mL)分別是

A. 560、672B. 1008、1120
C. 2240、2352D. 392、504
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為CaF2、H3BO3(層狀結構,層內的H3BO3分子通過氫鍵結合)、金屬銅三種晶體的結構示意圖,請回答下列問題:


圖Ⅲ 銅晶體中銅原子堆積模型
(1)圖Ⅰ所示的CaF2晶體中與Ca2+最近且等距離的F-數為________________,圖Ⅲ中未標號的銅原子形成晶體后周圍最緊鄰的銅原子數為__________________________________。
(2)圖Ⅱ所示的物質結構中最外能層已達8電子結構的原子是________,H3BO3晶體中B原子個數與極性鍵個數比為____________。
(3)金屬銅具有很好的延展性、導電性、傳熱性,對此現象最簡單的解釋是用________理論。
(4)三種晶體中熔點最低的是________(填化學式),其晶體受熱熔化時,克服的微粒之間的相互作用為____________________________________________________________。
(5)已知兩個距離最近的Ca2+核間距離為a×10-8cm,結合CaF2晶體的晶胞示意圖,CaF2晶體的密度為_______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com