
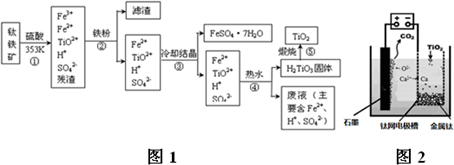
分析 第①步加硫酸溶解生成TiO2+和Fe2+、Fe3+等,第②步加鐵粉還原Fe3+,過濾除去濾渣,第③步冷卻結晶,過濾得到FeSO4•7H2O和含有TiO2+的溶液;第④步加熱,熱水使TiO2+水解生成H2TiO3,過濾得到H2TiO3;第⑤步H2TiO3受熱分解生成化生成TiO2.
(1)鐵粉將Fe3+轉化為Fe2+;
(2)溶液中析出晶體是利用物質溶解度的不同得到;
(3)②③④都是從溶液中得到固體的分離過程,需要用過濾裝置;
(4)依據溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,平衡影響因素和平衡移動原理分析判斷;
(5)廢液主要是亞鐵離子、氫離子和二氧化錳反應發生氧化還原反應生成錳離子和鐵離子;
(6)①依據裝置圖分析判斷,陽極生成二氧化碳氣體,是電解質中的氧離子失電子生成氧氣,氧氣和陽極石墨反應生成的二氧化碳;
②制備TiO2時,在電解槽發生如下反應:陰極:2Ca2++4e-═2Ca 陽極:2O2--4e-═O2↑,2Ca+TiO2$\frac{\underline{\;一定條件\;}}{\;}$Ti+2CaO,由此可見,CaO的量不變.
解答 解:(1)步驟②中,用鐵粉將Fe3+轉化為Fe2+的反應的離子方程式為:2Fe3++Fe=3Fe2+,故答案為:2Fe3++Fe═3Fe2+;
(2)步驟③冷卻結晶得到硫酸亞鐵晶體,利用的是物質溶解度的不同,通過冷卻熱飽和溶液得到,故答案為:b;
(3)②③④步驟的操作過程中都得到沉淀或晶體,所以需要過濾得到固體和溶液,故答案為:過濾;
(4)④中使用熱水的目的是促進TiO2+水解生成H2TiO3,分離出固體加熱得到TiO2;溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,當加入熱水稀釋、升溫后,
平衡正向移動,生成H2TiO3;
故答案為:溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,當加入熱水稀釋、升溫后,平衡正向移動,生成H2TiO3.
(5)利用生產過程中的廢液與軟錳礦(主要成分為MnO2)反應生產硫酸錳(MnSO4,易溶于水),利用二氧化錳的氧化性氧化亞鐵離子為三價鐵離子,反應的離子方程式為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案為:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(6)①用石墨作陽極、鈦網作陰極、熔融CaF2-CaO作電解質,陽極發生氧化反應,陰極析出鈣金屬發生還原反應,陽極圖示產物可可知,陽極生成二氧化碳氣體,是電解質中的氧離子失電子生成氧氣,氧氣和陽極石墨反應生成的二氧化碳,所以電極反應為:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案為:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②制備TiO2時,在電解槽發生如下反應:2CaO═2Ca+O2↑,2Ca+TiO2$\frac{\underline{\;一定條件\;}}{\;}$Ti+2CaO,由此可見,CaO的量不變;
或:制備TiO2時,在電解槽發生如下反應:陰極:2Ca2++4e-═2Ca,陽極:2O2--4e-═O2↑;2Ca+TiO$\frac{\underline{\;一定條件\;}}{\;}$Ti+2CaO,由此可見,CaO的量不變;
故答案為:制備TiO2時,在電解槽發生如下反應:2CaO═2Ca+O2↑,2Ca+TiO2$\frac{\underline{\;一定條件\;}}{\;}$Ti+2CaO,由此可見,CaO的量不變.
點評 本題考查了物質制備流程分析判斷,為高考常見題型,綜合考查實驗基本操作,離子方程式的書寫等,考查學生對所學知識的綜合應用能力,注意物質分離的流程分析判斷,物質性質的應用,題目難度中等


科目:高中化學 來源: 題型:解答題
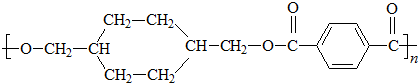
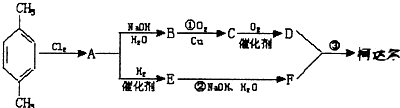
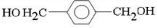 、D
、D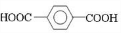 、E
、E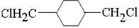 ;
;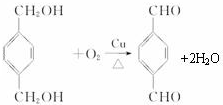
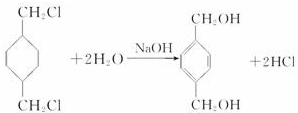 ;
; +
+ $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$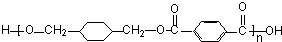 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
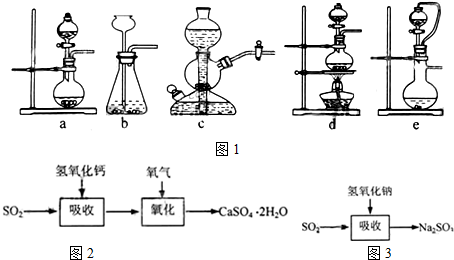
| 試劑 | Ca(OH)2 | NaOH |
| 價格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明礬凈水與液氯凈水的原理相同 | |
| B. | 將草木灰和硫銨混合施用,肥效更高 | |
| C. | 冬季形成的大霧屬于氣溶膠 | |
| D. | 電解精煉銅時,同一時間內陰極溶解銅的質量比陽極析出銅的質量小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 濾液A中的陽離子為Fe2+、Fe3+、H+ | B. | 樣品CuO的質量一定為4.0g | ||
| C. | 樣品中Fe元素的質量為56V/22400g | D. | 樣品中Fe元素的質量為2.24 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
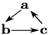 (“→”表示反應一步完成)關系轉化的是( )
(“→”表示反應一步完成)關系轉化的是( )| 選項 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
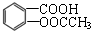 是一種常用的退熱、鎮痛藥物,臨床常用于預防心血管疾病.阿斯匹林對腸胃有一定的副作用,患有消化系統疾病的人不宜服用.則下列對此化合物說法不正確的是( )
是一種常用的退熱、鎮痛藥物,臨床常用于預防心血管疾病.阿斯匹林對腸胃有一定的副作用,患有消化系統疾病的人不宜服用.則下列對此化合物說法不正確的是( )| A. | 阿斯匹林能與NaHCO3反應,最多能與3mol H2發生加成反應 | |
| B. | 1 mol阿斯匹林與足量的NaOH溶液反應,消耗NaOH最大的物質的量為3 mol | |
| C. | 其苯環上的一氯取代物有兩種 | |
| D. | 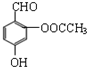 與阿斯匹林互為同分異構體,該有機物遇FeCl3溶液顯紫色 與阿斯匹林互為同分異構體,該有機物遇FeCl3溶液顯紫色 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com