
某溫度時,Ag2SO4在水中的沉淀溶解平衡曲線如圖所示。該溫度下,下列說法正確的是
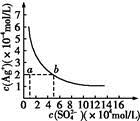
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. 0.02 mol·L-1的AgNO3溶液與0.02 mol·L-1的Na2SO4溶液等體積混合不會生成沉淀
C. Ag2SO4的溶度積常數(Ksp)為1×10-3
D. a點表示Ag2SO4的不飽和溶液,蒸發可以使溶液由a點變到b點
 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源:2016-2017學年江蘇省南京市高二學業水平模擬測試化學試卷(解析版) 題型:選擇題
下列化學用語表述正確的是
A. 苯的結構式: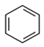 B. NaCl的電子式:Na∶Cl
B. NaCl的電子式:Na∶Cl
C. Mg的原子結構示意圖: D. 硫酸鐵的電離方程式:Fe2(SO4)3===2Fe2++3SO
D. 硫酸鐵的電離方程式:Fe2(SO4)3===2Fe2++3SO
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省揚州市寶應縣高二下學期學業水平測試(三)化學試卷(解析版) 題型:選擇題
X、Y、Z三種短周期元素在周期表中的位置如下圖所示。若X的最高正價與負價的代數和為2,則下列說法正確是
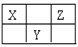
A. 原子序數由大到小為 Z >Y>X
B. 氫化物最穩定的元素為Z
C. 最高價氧化物的水化物酸性最強的元素為Z
D. 原子半徑由大到小為 Y>Z>X
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省揚州市寶應縣高二下學期學業水平測試(三)化學試卷(解析版) 題型:選擇題
實驗室制取氣體時,不能用排空氣法收集的是
A. NO B. NO2 C. NH3 D. SO2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省哈爾濱市高二3月月考化學試卷(解析版) 題型:填空題
物質在水中可能存在電離平衡、鹽的水解平衡和沉淀的溶解平衡,它們都可看作化學平衡.請根據所學知識的回答:
(1)A為0.1mol/L的(NH4)2SO4溶液,在該溶液中各種離子的濃度由大到小順序為________________
(2)B為0.1mol/LNaHCO3溶液,在NaHCO3溶液中存在的各種平衡體系為(用離子方程式表示):____________;___________;__________。
實驗測得NaHCO3溶液的pH>7,請分析NaHCO3溶液顯堿性的原因:________________
(3)C為FeCl3溶液,實驗室中配制FeCl3溶液時通常需要向其中加入________________目的是_____________;若把B和C溶液混合,將產生紅褐色沉淀和無色氣體,該反應的離子方程為_________________.
(4)D為含有足量AgCl固體的飽和溶液,氯化銀在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃時,氯化銀的Ksp=1.8×10-10mol2/L2.現將足量氯化銀分別放入:
① 100mL蒸餾水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化鋁溶液中;
④ 100mL 0.1mol/L鹽酸溶液中.充分攪拌后,相同溫度下銀離子濃度由大到小的順序_____________(填寫序號);②中氯離子的濃度為_________mol/L,③中銀離子的濃度為______mol/L
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省哈爾濱市高二3月月考化學試卷(解析版) 題型:選擇題
如下圖所示的三個容積相同的容器①②③中進行如下反應:3A(g)+B(g) 2C(g) ΔH<0,若起始溫度相同,分別向三個容器中通入3molA和1molB,則達到平衡時各容器中C物質的體積分數由大到小的順序為 ( )
2C(g) ΔH<0,若起始溫度相同,分別向三個容器中通入3molA和1molB,則達到平衡時各容器中C物質的體積分數由大到小的順序為 ( )

A. ③②① B. ③①② C. ①②③ D. ②①③
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省哈爾濱市高二3月月考化學試卷(解析版) 題型:選擇題
把下列四種X溶液分別加入四個盛有10mL 2mol/L的鹽酸溶液的燒杯中(忽略體積變化),X和鹽酸緩慢地進行反應,其中反應最快的是
A. 20mL 3mol/L 的X溶液 B. 30mL 2mol/L 的X溶液
C. 10mL 4mol/L 的X溶液 D. 20mL 2mol/L 的X溶液
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省洛陽市高二(平行班)3月月考化學試卷(解析版) 題型:選擇題
下列化學用語應用正確的是( )
A. 乙烯的結構簡式:CH2CH2 B. 乙醇的分子式:CH3CH2OH
C. 甲烷的結構式:CH4 D. 甲苯的鍵線式:
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省蘇州市高三上學期期末考試化學試卷(解析版) 題型:選擇題
80℃時,NO2(g)+SO2(g) SO3(g)+ NO (g)。該溫度下,在甲、乙、丙三個體積相等且恒容的密閉容器中,投入NO2和SO2,起始濃度如下表所示,其中甲經2min達平衡時,NO2的轉化率為50%,下列說法正確的是
SO3(g)+ NO (g)。該溫度下,在甲、乙、丙三個體積相等且恒容的密閉容器中,投入NO2和SO2,起始濃度如下表所示,其中甲經2min達平衡時,NO2的轉化率為50%,下列說法正確的是
起始濃度 | 甲 | 乙 | 丙 |
c(NO2)/mol • L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol • L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反應在前2 min的平均速率v(SO2)=0.05 mol • L-1• min-1
B. 達到平衡時,容器丙中正反應速率與容器甲相等
C. 溫度升至90℃,上述反應平衡常數為1.56,則反應的△H>0
D. 容器乙中若起始時改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,達到平衡時c(NO)與原平衡相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com