
【題目】重鉻酸鉀是一種重要的化工原料,一般由鉻鐵礦制備,鉻鐵礦的主要成分為FeO·Cr2O3,還含有硅、鋁等雜質。制備流程如圖所示:
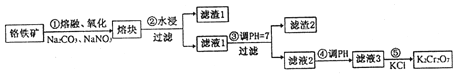
回答下列問題:
(1)步驟①的主要反應為:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反應配平后FeO·Cr2O3與NaNO3的系數比為__________。該步驟不能使用陶瓷容器,原因是______。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反應配平后FeO·Cr2O3與NaNO3的系數比為__________。該步驟不能使用陶瓷容器,原因是______。
(2)濾渣1中含量最多的金屬元素是_________,濾渣2的主要成分是________及含硅雜質。
(3)步驟④調濾液2的pH使之變______(填“大”或“小”),原因是______(用離子方程式表示)。
(4)某工廠用76 kg 鉻鐵礦粉(含Cr2O3 40%)制備K2Cr2O7,最終得到產品41.16kg,則產率為_______。
【答案】 7:2 不能 Fe A1(OH)3 小 2CrO42-+2H+=Cr2O72-+H2O 70%
【解析】(1) FeO·Cr2O3是還原劑,完全氧化為Na2CrO4和Fe2O3,每mol轉移7mol電子,而NaNO3是氧化劑,還原產物為NaNO2,每mol轉移2mol電子,根據電子守恒可知,FeO·Cr2O3和NaNO3的系數比為 7:2,烙塊在高溫下會與Na2CO3反應,則熔融時不能使用陶瓷容器;(2)熔塊中氧化鐵不溶于水,過濾后進入濾渣1,則濾渣1中含量最多的金屬元素是鐵,濾液1中含有AlO2-、SiO32-及CrO42-,調節溶液pH并過濾后得濾渣2為A1(OH)3;(3)濾液2調節pH的目的是提高溶液的酸性,pH變小;因為溶液中存在2CrO42-+2H+=Cr2O72-+H2O,增大溶液中H+濃度,可促進平衡正向移動,提高溶液中Cr2O72-的濃度;(4)樣品中Cr2O3的質量為76 kg ×40%=30.4kg,則生成K2Cr2O7 的理論質量為30.4kg×![]() =58.8kg,則所得產品的產率為
=58.8kg,則所得產品的產率為![]() ×100%=70%。
×100%=70%。


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:
【題目】《本草綱目》中的“石堿”條目下寫道:“采蒿蓼之屬,曬干燒灰,以水淋汁,久則凝淀如石,浣衣發面,亦去垢發面。”下列說法錯誤的是( )
A.“石堿”中含有離子鍵B.“石堿”中含有非極性共價鍵
C.“石堿”是離子化合物D.“石堿”中含有極性共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用海水制取氯氣、燒堿、溴及鎂等工藝示意圖如下:
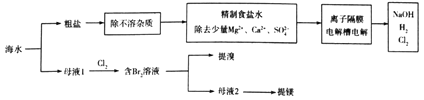
下列說法正確的是
A. “精制食鹽水”時藥品使用順序為Na2CO3(aq)、NaOH(aq)、BaCl2(aq)及鹽酸
B. 使用離子隔膜電解槽電解飽和食鹽水時,其中的“隔膜”是“陽離子交換膜”
C. 工業上“母液1”氧化得到“含Br2溶液”后可直接用CCl4萃取,然后蒸餾得粗溴
D. “母液2”需經過加石灰乳生成沉定Mg(OH)2、過濾、鹽酸溶解,然后直接電解得到鎂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2(g)+I2(g)2HI(g)已經達到平衡狀態的標志是( )
①c(H2)=c(I2)=c(HI)
②c(H2):c(I2):c(HI)=1:1:2
③c(H2)、c(I2)、c(HI)不再隨時間而改變
④單位時間內生成nmolH2的同時生成2nmolHI
⑤單位時間內生成n mol H2的同時生成n mol I2
⑥反應速率v(H2)=v(I2)= ![]() v(HI)
v(HI)
⑦一個H﹣H鍵斷裂的同時有兩個H﹣I鍵斷裂
⑧溫度和體積一定時,容器內壓強不再變化
⑨溫度和體積一定時,混合氣體的顏色不再變化
⑩溫度和壓強一定時,混合氣體的密度不再變化
條件一定,混合氣體的平均相對分子質量不再變化.
A.5項
B.4項
C.3項
D.2項
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中,在一定條件下既能起加成反應,也能起取代反應,但不能使KMnO4酸性溶液褪色的是( )
A. 乙烷 B. 苯 C. 乙烯 D. 乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有a、b兩個極易導熱的密閉容器,a保持容積不變,b中的活塞可上下移動,以保持內外壓強相等.在相同條件下將3molA、1molB分別同時混合于a、b兩容器中,發生反應:
3A(g)+B(g)2C(g)+D(g)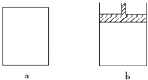
(1)達平衡時,a中A的濃度為M molL﹣1 , C的濃度為N molL﹣1 , b中A的濃度為m molL﹣1 , C的濃度為n molL﹣1 , 則Mm;Nn; (填“>”或“<”或“=”或“無法比較”)
(2)保持溫度不變,按下列配比分別充入 a、b 兩容器,達平衡后a中C的濃度為N molL﹣1的是 , b中C的濃度為n molL﹣1的是
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若將2molC和2molD充入a中,保持溫度不變,平衡時A的濃度為WmolL﹣1 , C的濃度為YmolL﹣1 , 則W和M,Y和N之間的關系為WM、YN. (填>、<、=、無法比較)
(4)保持溫度不變,若將4molC和2molD充入a中,平衡時A的濃度為R molL﹣1 , 則關系式正確的是
A.R=2M
B.R<M
C.M<R<2M
D.R>2M
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知NaHA水溶液呈堿性。
①用離子方程式表示NaHA水溶液呈堿性的原因:______________________________。
②在NaHA水溶液中各離子濃度的大小關系是:______________________________。
(2)25℃,兩種酸的電離平衡常數如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的電離平衡常數表達式K=______。
②H 2SO3溶液和NaHCO3溶液反應的主要離子方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4═FeSO4+H2↑的能量變化趨勢如圖所示: 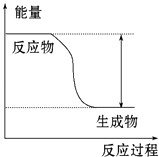
(1)該反應為反應(填“吸熱”或“放熱”).
(2)若要使該反應的反應速率加快,下列措施可行的是(填字母).
A.改鐵片為鐵粉
B.改稀硫酸為98%的濃硫酸
C.升高溫度
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為(填“正”或“負”)極.銅片上的現象為該極上發生的電極反應為 , 外電路中電子由極(填“正”或“負”,下同)向極移動.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com