
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 實驗 編號 | T(℃) | NO初始濃度 (mol/L) | CO初始濃度 (mol/L) | 催化劑的比表面積(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
分析 (1)前2s內的平均反應速率υ(CO)=$\frac{(3.60-2.85)×1{0}^{-3}mol/L}{2s}$=0.375mol/(L.s),根據同一段時間內各物質的反應速率之比等于其計量數之比計算υ(N2);
參加反應的c(CO)=(3.60-2.70)×10-3mol/L,CO轉化率=$\frac{參加反應的c(CO)}{反應初始c(CO)}$×100%;
(2)化學平衡常數K等于生成物濃度冪之積與反應物濃度冪之積的比;
(3)該反應是一個反應前后氣體體積減小的放熱反應,增大壓強、降低溫度、增大NO濃度、減小生成物濃度都能增大CO轉化率;
(4)①利用控制變量法分析解答,Ⅰ、Ⅱ研究的是催化劑的比表面積對速率的影響,Ⅱ、Ⅲ的催化劑比表面積相同,研究的是溫度對速率的影響,Ⅰ、Ⅲ催化劑的比表面積不同,溫度不同,研究溫度、催化劑的比表面積對反應速率的影響;
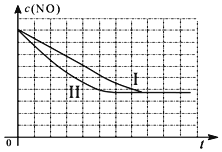
②繪圖時,要注意達平衡的時間、平衡濃度的相對大小:Ⅱ與Ⅰ溫度相同,平衡不移動,平衡濃度相同,但Ⅱ催化劑比表面積增大,達平衡時間短;
Ⅲ與Ⅱ的催化劑比表面積相同,Ⅲ溫度高,溫度升高,不僅達平衡時間縮短,平衡向左移動,使NO的平衡濃度也增大.
解答 解:(1)前2s內的平均反應速率υ(CO)=$\frac{(3.60-2.85)×1{0}^{-3}mol/L}{2s}$=0.375 mol/(L.s),根據同一段時間內各物質的反應速率之比等于其計量數之比得υ(N2)=$\frac{1}{2}$υ(CO)=$\frac{1}{2}$×0.375 mol/(L.s)=1.875×10-4mol/(L•s),
參加反應的c(CO)=(3.60-2.70)×10-3mol/L,CO轉化率=$\frac{參加反應的c(CO)}{反應初始c(CO)}$×100%=$\frac{(3.60-2.70)×1{0}^{-3}mol/L}{3.60×1{0}^{-3}mol/L}×100%$=25%;
故答案為:1.875×10-4mol/(L•s);25%;
(2)化學平衡常數K等于生成物濃度冪之積與反應物濃度冪之積的比,則K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$,
故答案為:K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$;
(3)A.選用更有效的催化劑只改變化學反應速率,不影響平衡移動,則不能提高CO轉化率,故A錯誤;B.升高反應體系的溫度,平衡逆向移動,降低CO轉化率,故B錯誤;
C.降低反應體系的溫度,平衡正向移動,提高CO轉化率,故C正確;
D.縮小容器的體積,增大壓強平衡正向移動,提高CO轉化率,故D正確;
故選CD;
(4)①利用控制變量法分析解答,Ⅰ、Ⅱ研究的是催化劑的比表面積對速率的影響,Ⅱ、Ⅲ的催化劑比表面積相同,研究的是溫度對速率的影響,Ⅰ、Ⅲ催化劑的比表面積不同,溫度不同,研究溫度、催化劑的比表面積對反應速率的影響,故目的是:分別驗證溫度、催化劑比表面積對化學反應速率的影響規律,
故答案為:分別驗證溫度、催化劑比表面積對化學反應速率的影響規律;
②Ⅱ與Ⅰ溫度相同,平衡不移動,平衡濃度相同,但Ⅱ催化劑比表面積增大,達平衡時間短,
Ⅲ與Ⅱ的催化劑比表面積相同,Ⅲ溫度高,溫度升高,不僅達平衡時間縮短,平衡向左移動,使NO的平衡濃度也增大,三個實驗條件下混合氣體中NO濃度隨時間變化的趨勢曲線圖為: ,
,
故答案為: .
.
點評 本題考查化學平衡的計算、化學平衡常數、平衡移動影響因素、影響速率因素探究實驗等,為高頻考點,側重考查學生分析判斷計算能力,(4)中注意利用控制變量法分析解答,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉的電子式: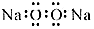 | B. | 次氯酸鈉的結構式:H-Cl-OC | ||
| C. | 氯化銨的電子式: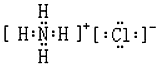 | D. | 硫離子的結構示意圖: |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com