
【題目】某興趣小組模擬氯堿工業生產原理并探究其產品的性質。已知文獻記載:
①氯氣與冷的氫氧化鈉溶液反應生成NaClO;氯氣與熱的氫氧化鈉溶液反應可生成NaClO和NaClO3。②在酸性較弱時KI只能被NaClO氧化,在酸性較強時亦能被NaClO3氧化。
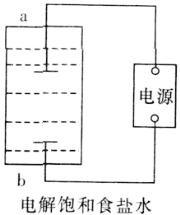
(1)該小組利用如圖所示裝置制取家用消毒液(主要成分為NaClO),則a為_______(填“陽極”或“陰極”)。生成NaClO的離子方程式為________。
(2)該小組將0.784L(標準狀況)Cl2通入50.00mL熱的NaOH溶液中,兩者恰好完全反應后,稀釋到250.0mL。
Ⅰ.取稀釋后的溶液25.00mL用醋酸酸化,加入過量KI溶液。用0.2000mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL時恰好到達終點。
Ⅱ.將上述滴定后的溶液用鹽酸酸化至強酸性,再用上述Na2S2O3溶液滴定到終點,需Na2S2O3溶液30.00mL。
①操作Ⅱ中氯酸鈉與碘化鉀反應的離子方程式為________。
②反應后的溶液中次氯酸鈉和氯酸鈉的物質的量之比為________。
【答案】陰極Cl2+2OH-=Cl-+ClO-+H2OClO3-+6I-+6H+=Cl-+3I2+3H2O1︰1
【解析】
(1)根據裝置圖可判斷b電極應該生成氯氣,a電極生成了氫氧根,溶液中水電離的氫離子得到電子被還原,所以a為陰極,反應生成NaClO的離子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(2)①酸性較強條件下,NaClO3將I-氧化成I2,根據化合價升降相等配平,反應的離子方程式是ClO3-+6I-+6H+=Cl-+3I2+3H2O;
②用醋酸酸化,只有次氯酸鈉氧化碘化鉀,消耗Na2S2O3溶液10.00mL,由關系式ClO-~2I-~I2~2S2O32-可知n(NaClO)=n(I2)=0.5×n(S2O32-)=0.5×0.2000mol/L×0.010L=0.001mol;用鹽酸酸化至強酸性,氯酸鉀氧化碘化鈉,消耗Na2S2O3溶液30.00mL;根據關系式:ClO3-~6I-~3I2~6S2O32-可知n(NaClO3)=n(S2O32-)×1/6=0.2000mol/L×0.03L×1/6=0.001mol;故n(NaClO):n(NaClO3)=1:1。


 教學練新同步練習系列答案
教學練新同步練習系列答案 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案 黃岡小狀元口算速算練習冊系列答案
黃岡小狀元口算速算練習冊系列答案 成功訓練計劃系列答案
成功訓練計劃系列答案 倍速訓練法直通中考考點系列答案
倍速訓練法直通中考考點系列答案科目:高中化學 來源: 題型:
【題目】已知:將Cl2通入適量KOH溶液,產物中可能有KCl、KClO、KClO3,且![]() 的值與溫度高低有關。當n(KOH)=a mol,下列有關說法錯誤的是
的值與溫度高低有關。當n(KOH)=a mol,下列有關說法錯誤的是
A.若某溫度下,反應后![]() =11,則溶液中
=11,則溶液中![]() =
=![]()
B.參加反應的氯氣的物質的量等于![]() a mol
a mol
C.改變溫度,反應中轉移電子的物質的量ne的范圍:![]() a mol = ne =
a mol = ne = ![]() a mol
a mol
D.改變溫度,產物中KClO3的最大理論產量為![]() a mol
a mol
查看答案和解析>>
科目:高中化學 來源: 題型:
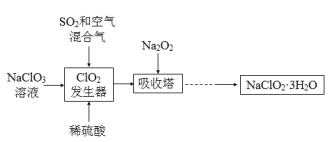
【題目】亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌。以下是過氧化物法生產亞氯酸鈉的工藝流程圖:
已知:
①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO2·3H2O;
②純ClO2易分解爆炸,一般用稀有氣體或空氣稀釋至10%以下較安全;
(1)NaClO2中Cl的化合價為______。
(2)在發生器中鼓入SO2和空氣混合氣的原因是______ (填序號)。
A 空氣稀釋ClO2以防止爆炸
B SO2將NaClO3氧化成ClO2
C 稀硫酸可以增強NaClO3的氧化性
(3)Na2O2可改為H2O2和NaOH的混合溶液,吸收塔中發生的反應的化學方程式______;吸收塔的溫度不能超過20oC,主要原因是______。
(4)從濾液中得到NaClO2·3H2O粗晶體的實驗操作依次是______ (填序號)。
A 蒸餾 B 蒸發濃縮 C 灼燒 D 過濾 E 冷卻結晶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以惰性電極電解CuSO4和NaCl的混合溶液,兩電極上產生的氣體(標準狀況下測定)體積如下圖所示,下列有關說法正確的是

A.a表示陰極上產生的氣體,t1前產生的為Cl2
B.原溶液中CuSO4和NaCl物質的量之比為1:1
C.若t2時溶液的體積為1 L,此時溶液的pH為13
D.若原溶液體積為1 L,則原溶液中SO42的物質的量濃度為0.2 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定物質的量的Cl2與NaOH溶液反應,所得產物中含NaClO和NaClO3物質的量之比為3∶5,則參加反應的Cl2與NaOH物質的量之比為( )
A. 8∶11 B. 3∶5 C. 1∶2 D. 18∶8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一個可變容積的密閉容器中進行,試回答:
Fe3O4 (s)+4H2(g) ,在一個可變容積的密閉容器中進行,試回答:
(1)增加Fe的量,其正反應速率的變化是__________(填“增大”“不變”或“減小”,以下相同)。
(2)將容器的體積縮小一半,其正反應速率__________,逆反應速率__________。
(3)保持體積不變,充入N2 使體系壓強增大,其正反應速率__________,逆反應速率__________。
(4)保持壓強不變,充入N2使容器的體積增大,其正反應速率__________,逆反應速率__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以葡萄糖為燃料的微生物燃料電池結構示意圖如圖所示.關于該電池的敘述不正確的是( )
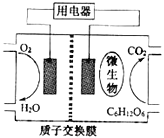
A. 該電池能夠在高溫下工作
B. 電池的負極反應為:C6H12O6+6H2O-24e-=6CO2+24H+
C. 放電過程中,質子(H+)從負極區向正極區遷移
D. 在電池反應中,每消耗1mol氧氣,理論上能生成標準狀況下CO2氣體22.4 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過一步反應不能直接完成的是
①N2→NO2 ②NO2→NO ③NH3→NO ④NO→HNO3 ⑤Cu→Cu(NO3)2 ⑥HNO3→NO2
A. ①⑤B. ①C. ①④⑥D. ①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com