
分析 (1)根據反應①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1,
根據蓋斯定律:②+③×2-①得到所需熱化學方程式和焓變;
(2)提高反應速率可增大濃度、壓強、溫度或加入催化劑;
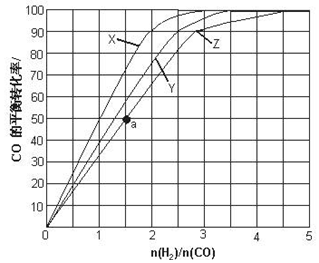
(3)①正反應放熱,則升高溫度CO的轉化率降低;
②由圖可知,溫度越高,CO的轉化率越低,CO和 H2的起始組成比越小,CO的轉化率越大;
(4)計算出平衡時各物質的濃度,結合K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$計算.
解答 解:(1)根據反應①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1,
根據蓋斯定律:②+③×2-①得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(2)提高反應速率可增大濃度、壓強、溫度或加入催化劑,則B、D正確,而移去部分CH3OH、減小壓強可減小反應速率,故答案為:BD;
(3)①根據該反應為放熱反應,溫度越高CO的轉化率越小,所以曲線X為230℃,故答案為:230℃;
②由圖可知,溫度越高,CO的轉化率越低,CO和 H2的起始組成比越小,CO的轉化率越大,
故答案為:溫度越高,CO的轉化率越低或n(H2):n(CO)越低,CO的轉化率越大;
(4)由圖象可知a點對應CO的轉化率為50%,n(H2):n(CO)=1.5,則
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
轉化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4.00,
答:2H2(g)+CO(g)?CH3OH (g)的平衡常數為4.00.
點評 本題考查化學平衡問題,側重于學生的分析和計算能力的考查,為高考常見題型和高頻考點,注意把握圖象曲線的變化趨勢,把握平衡常數的計算方法,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
| 反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
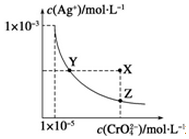 在t℃時,Ag2CrO4(橘紅色)在水中的沉淀溶解平衡曲線如圖所示.又知t℃時AgBr的Ksp=5.0×10-13,下列說法錯誤的是( )
在t℃時,Ag2CrO4(橘紅色)在水中的沉淀溶解平衡曲線如圖所示.又知t℃時AgBr的Ksp=5.0×10-13,下列說法錯誤的是( )| A. | t℃時,Ag2CrO4的Ksp為1×10-8 | |
| B. | 在飽和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y點變為X點 | |
| C. | 一定溫度下Y點和Z點時Ag2CrO4的Ksp相等 | |
| D. | 在t℃時,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常數K=4.0×1010 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 圖示中,A為一種常見的單質,B、C、D、E是含有A元素的常見化合物,它們的焰色反應均為黃色.請填寫下列空白:
圖示中,A為一種常見的單質,B、C、D、E是含有A元素的常見化合物,它們的焰色反應均為黃色.請填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3的電子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 酸堿中和在化工生產中有著重要應用.
酸堿中和在化工生產中有著重要應用.查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X的氣態氫化物的熱穩定性比O(氧)的強 | |
| B. | 元素Z、W的簡單離子具有相同的電子層結構 | |
| C. | Y、Z、W的最高價氧化物對應的水化物之間能相互反應 | |
| D. | 等質量的Y和Z單質分別與足量稀鹽酸反應,前者產生的氫氣多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 2016年8月10日《生物谷》載文稱,“毒性氣體”CO、NO及H2S可作為新型藥物開發的潛在靶點,用以開發更多新型藥物來幫助治療多種人類疾病.下列有關這三種氣體的說法正確的是( )
2016年8月10日《生物谷》載文稱,“毒性氣體”CO、NO及H2S可作為新型藥物開發的潛在靶點,用以開發更多新型藥物來幫助治療多種人類疾病.下列有關這三種氣體的說法正確的是( )| A. | 都是電解質 | B. | 都易溶于水 | ||
| C. | 都能與堿溶液反應 | D. | 都屬于共價化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com