
| A. | PCl5 | B. | SiH4 | C. | NF3 | D. | CO2 |
分析 對于共價化合物,元素化合價的絕對值+該元素原子核外電子數=8,該原子滿足8電子結構.對應ABn分子,若中心原子最外層電子數=化合價的絕對值,分子為非極性分子,據此判斷.
解答 解:A.PCl5中P元素化合價為+5,P原子最外層電子數為5,所以5+5=10,分子中P原子不滿足8電子結構,P元素化合價=最外層電子數,為非極性分子,故A錯誤;
B.SiH4中Si元素化合價為+4,Si原子最外層電子數為4,所以4+4=8,分子中Si原子滿足8電子結構,H原子一定不滿足8電子結構,C元素化合價=最外層電子數,為非極性分子,故B錯誤;
C.NF3中N元素化合價為+3,N原子最外層電子數為5,所以3+5=8,分子中N原子滿足8電子結構;F元素化合價為-1,F原子最外層電子數為7,所以|-1|+7=8,分子中F原子滿足8電子結構,N元素化合價≠最外層電子數,為極性分子,故C錯誤;
D.CO2中C元素的化合價為+4,C原子核外電子數為4,所以4+4=8,C原子滿足8電子結構;O元素化合價為-2,O原子最外層電子數為6,所以|-2|+6=8,O原子滿足8電子結構,C元素化合價=最外層電子數,為非極性分子,故D正確;
故選D.
點評 本題考查分子8電子結構判斷與分子極性,難度不大,掌握判斷規律是解題的關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑 A>B>D>C | |
| B. | 原子序數 d>c>b>a | |
| C. | 離子半徑 C>D>B>A | |
| D. | 原子結構的最外層電子數目 A>B>D>C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 穩定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸點:H2O>NH3 | D. | 還原性:HI>HBr>HCl>HF |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
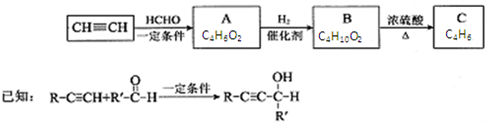
 ,其反應類型消去反應.
,其反應類型消去反應.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com