
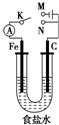
| A. | 若電鍵K與N連接,鐵被保護不會腐蝕 | |
| B. | 若電鍵K與M連接,將石墨棒換成銅棒,可實現鐵棒上鍍銅 | |
| C. | 若電鍵K與N連接,正極反應式是 4OH--4e-═2H2O+O2↑ | |
| D. | 若電鍵K與M連接,當兩極共產生22.4L(標準狀況)氣體時,生成了1mol NaOH |
分析 若電鍵K與N連接,該裝置沒有外接電源,所以構成了原電池;組成原電池時,較活潑的金屬鐵作負極,負極上鐵失電子發生氧化反應;石墨棒作正極,正極上氧氣得電子生成氫氧根離子發生還原反應;
若電鍵K與M連接,該裝置是電解池,碳作陽極,鐵作陰極,陽極上氯離子放電,陰極上氫離子放電.
解答 解:A、若電鍵K與N連接,該裝置構成了原電池,較活潑的金屬鐵作負極,鐵會加快腐蝕,故A錯誤;
B、若電鍵K與M連接,構成電解池,將石墨棒換成銅棒,是電解池的陽極,鐵棒是陰極,電解質溶液換成CuSO4溶液就可以實現鐵棒上鍍銅,如果電解質溶液仍然是氯化鈉溶液,不能實現鐵棒上鍍銅,故B錯誤;
C、若電鍵K與N連接,該裝置構成了原電池,不活潑的石墨棒作正極,正極上氧氣得電子生成氫氧根離子發生還原反應,電極反應式為2H2O+O2+4e-=4OH-,故C錯誤;
D.若電鍵K與M連接,該裝置是電解池,電池反應式為:2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+Cl2↑+H2 ↑,當兩極共產生22.4L(標準狀況)即1mol氣體時,生成1molNaOH,故D正確;
故選D.
點評 本題考查原電池和電解池原理,明確電極上發生的反應是解本題關鍵,注意電解池中陽極如果是活潑電極發生的電極反應,為易錯點,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:多選題
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶質濃度大小:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 室溫下若0.3mol•L-1HY溶液與0.3mol•L-1NaOH溶液等體積混合后,溶液的pH=9,則c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1 | |
| C. | 室溫下0.2mol•L-1HCl溶液與等體積0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | NaHCO3溶液中:c(OH-)═c(H+)+c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②⑤ | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應的△H>0 | |
| B. | NH3的體積分數不變時,該反應一定達到平衡狀態 | |
| C. | A點對應狀態的平衡常數K(A)=10-2.294 | |
| D. | 30℃時,B點對應狀態的υ(正)<υ(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨氣具有還原性,可用于檢查HCl泄漏 | |
| B. | 濃硫酸具有脫水性,可用于干燥CO2 | |
| C. | 氧化鋁具有高熔點,可用于生產耐火磚 | |
| D. | Cl2有酸性,可與燒堿反應制備含氯消毒劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 活化分子具有的能量就是活化能 | |
| B. | 增大反應物濃度,可增大活化分子的百分數,從而使有效碰撞次數增大 | |
| C. | 無論是吸熱反應還是放熱反應,升高溫度都能增大活化分子百分數 | |
| D. | 活化分子間的碰撞一定是有效碰撞 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com