
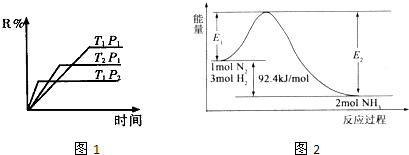
| 4-1.6 |
| 4 |


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:
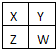 已知X、Y、Z、W為短周期主族元素,在周期表中的相對位置如圖所示,下列說法正確的是( )
已知X、Y、Z、W為短周期主族元素,在周期表中的相對位置如圖所示,下列說法正確的是( )| A、若四種元素均為非金屬,則W的最高價氧化物對應的水化物一定是強酸 |
| B、若HmXOn為強酸,則X的氫化物溶于水一定顯酸性(m、n均為正整數) |
| C、若四種元素均為金屬,則Z的最高價氧化物對應的水化物一定為強堿 |
| D、若四種元素中只有一種為金屬,則Z與Y的最高價氧化物對應的水化物能反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:
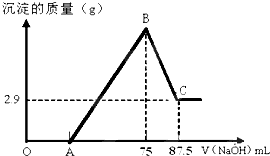 將一定量鎂和鋁的混合粉末加入50mL未知濃度的硫酸中,攪拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的體積與產生沉淀的量如下圖所示,請回答下列問題:
將一定量鎂和鋁的混合粉末加入50mL未知濃度的硫酸中,攪拌,得到澄清溶液.在此溶液中逐滴滴入8mol/L的NaOH溶液,滴加NaOH溶液的體積與產生沉淀的量如下圖所示,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
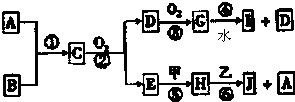
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、需要加熱才能發生的反應一定是吸熱反應 |
| B、任何放熱的反應在常溫條件下一定能發生反應 |
| C、吸熱反應只能在加熱的條件下才能進行 |
| D、反應是放熱還是吸熱是由反應物和生成物所具有的總能量所決定的 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com