

分析 (1)合成氨反應方程式為3H2(g)+N2(g)?2NH3(g)、2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)、CO(g)+$\frac{1}{2}$O2(g)?CO2(g),將這三個方程式相加得3H2(g)+N2(g)+CO(g)+$\frac{1}{2}$O2(g)?CO(NH2)2(s)+H2O,據此判斷H2、CO的合適體積比;
(2)該反應的平衡常數表達式為K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
(3)可逆反應達到平衡狀態時,正逆反應速率相等,反應體系中各物質的物質的量不變、物質的量濃度不變、百分含量不變以及由此引起的一系列物理量不變;
(4)增大壓強平衡向氣體體積減小的方向移動;
由于該反應中,氣體每減小2mol,生成1molCO(NH2)2是固體,氣體質量減小60g,即減少的混合氣體的平均相對分子質量為30,當起始混合氣體的相對分子質量為30時,平衡正向移動,但混合氣體的平均相對分子質量始終為30,所以加壓時混合氣體的平均相對分子質量不變;
(5)HCl和氨氣生成氯化銨,平衡逆向移動;混合氣體的相對分子質量增大.
解答 解:(1)合成氨反應方程式為3H2(g)+N2(g)?2NH3(g)、2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)、CO(g)+$\frac{1}{2}$O2(g)?CO2(g),將這三個方程式相加得3H2(g)+N2(g)+CO(g)+$\frac{1}{2}$O2(g)?CO(NH2)2(s)+H2O,根據方程式知H2、CO的合適體積比為3:1,
故答案為:3:1;
(2)該反應的平衡常數表達式為K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$,故答案為:$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
(3)A.無論反應是否達到平衡狀態都存在消耗NH3的物質的量的生成H2O的物質的量之比為2:1,不能據此判斷平衡狀態,故錯誤;
B.當c(NH3):c(CO2):c(H2O)=2:1:1時該反應不一定達到平衡狀態,與反應物初始濃度及轉化率有關,故錯誤;
C.反應前后氣體質量改變、容器體積不變,所以氣體密度改變,當氣體密度不再變化時正逆反應反應速率相等,該反應達到平衡狀態,故正確;
D.該反應前后氣體計量數之和不等,當氣體壓強不再變化時,正逆反應速率相等,反應達到平衡狀態,故正確;
故選CD;
(4)該反應的正反應是反應前后氣體體積減小的可逆反應,增大壓強平衡向氣體體積減小的方向移動,所以向正反應方向移動;
由于該反應中,氣體每減小2mol,生成1molCO(NH2)2是固體,氣體質量減小60g,即減少的混合氣體的平均相對分子質量為30,當起始混合氣體的相對分子質量為30時,平衡正向移動,但混合氣體的平均相對分子質量始終為30,設NH3與CO2的物質的量分別是x、y,其平均摩爾質量=$\frac{17x+44y}{x+y}g/mol=30g/mol$,x:y=14:13,
故答案為:正反應;14:13;
(5)HCl和氨氣生成氯化銨,平衡逆向移動;二氧化碳相對分子質量大于水蒸氣,所以混合氣體的相對分子質量增大,故答案為:逆反應;增大.
點評 本題考查化學平衡計算、化學平衡狀態判斷、化學平衡影響因素等知識點,較綜合,難點是(4)題計算,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| 選項 | 陳述I | 陳述II |
| A | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
| B | SiO2導電能力強 | 可用于制造通訊光纜 |
| C | Al有還原性,在某些反應中熱效應大 | 利用鋁熱反應冶煉金屬Mn |
| D | 常溫下鐵與濃硫酸、濃硝酸均不反應 | 可用鐵槽車密封運送濃硫酸、濃硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl | B. | Na2SO4 | C. | CuSO4 | D. | NaCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 溴乙烷是一種重要的化工合成原料.實驗室合成溴乙烷的反應和實驗裝置如下:
溴乙烷是一種重要的化工合成原料.實驗室合成溴乙烷的反應和實驗裝置如下:| 物 質 | 相對分子質量 | 沸點(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 難溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 濃硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
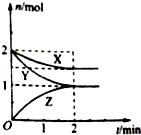 在容積固定的2L密閉容器中,一定條件下發生如下反應:X(g)+2Y(g)?nZ(g),反應過程中各物質的量與時間的關系如圖所示.完成下列填空:
在容積固定的2L密閉容器中,一定條件下發生如下反應:X(g)+2Y(g)?nZ(g),反應過程中各物質的量與時間的關系如圖所示.完成下列填空:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉可用于食品、羽毛和織物等的漂白 | |
| B. | 含鹽腌制品不宜直接存放在鋁制容器中 | |
| C. | 燃放煙花是利用了某些金屬元素的焰色反應 | |
| D. | 鋁比鐵活潑,但鋁制品比鐵制品在空氣中耐腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用分液漏斗前不用檢查活塞處是否漏水 | |
| B. | 放氣時,直接打開上口玻璃塞 | |
| C. | 分液操作時,下層液體從下端放出,上層液體從上口倒出 | |
| D. | 應選用球形分液漏斗進行分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com