
【題目】需要加入適當的氧化劑才能實現的反應
A. PCl3→PCl5 B. MnO4- →Mn2+ C. SO3→HSO4- D. CO2→H2CO3
 精英口算卡系列答案
精英口算卡系列答案 應用題點撥系列答案
應用題點撥系列答案科目:高中化學 來源: 題型:
【題目】異秦皮啶具有抗腫瘤功效,秦皮素具有抗痢疾桿菌功效。它們在一定條件下可發生轉化,如圖所示。有關說法正確的是
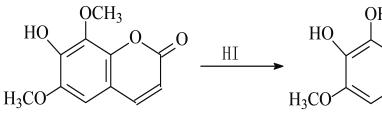
A. 異秦皮啶分子式為C11H10O5
B. 異秦皮啶與秦皮素互為同系物
C. 鑒別異秦皮啶與秦皮素可用FeCl3溶液
D. 1 mol秦皮素最多可與3 mol NaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是干電池的生產和消費大國。某科研團隊設計了以下流程對廢舊堿性鋅錳干電池的資源進行回收:

已知:
①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2開始沉淀時pH為8.3,完全沉淀的pH為9.8
③ 0.1 mol/L NaHCO3溶液的pH約為8;0.1 mol/L Na2CO3溶液的pH約為11。
(1)堿性鋅錳干電池是以鋅粉為負極,二氧化錳為正極,氫氧化鉀溶液為電解質。電池總反應為:2MnO2+Zn+2KOH= 2MnOOH+K2ZnO2,請寫出電池的正極反應式________________________________;
(2)為了提高碳包的浸出效率,可以采取的措施有______________________________;(寫一條即可)
(3)向濾液1中加入MnS的目的是__________________________________________;
(4)已知MnSO4的溶解度曲線如圖所示,從濾液2中析出MnSO4·H2O晶體的操作是蒸發結晶、____________________、洗滌、低溫干燥;

(5)為了選擇試劑X,在相同條件下,分別用3 g碳包進行制備MnSO4的實驗,得到數據如下表,請寫出最佳試劑X與碳包中的主要成分發生反應的化學方程式________________。
實驗編號 | 試劑X | MnSO4/g |
1 | 鋅粉 | 2.4 |
2 | 鐵粉 | 2.7 |
3 | FeS粉末 | 3.0 |
4 | 30%過氧化氫 | 3.7 |
(6)工業上經常采用向濾液2中加入NaHCO3溶液來制備MnCO3,不選擇Na2CO3溶液的原因是_______________________________________;
(7)該科研小組利用EDTA(乙二胺四乙酸二鈉,陰離子簡寫為Y2-)進行絡合滴定,測定Mn元素在電池中的質量百分數。
實驗過程如下:
①將一節廢舊堿性鋅錳干電池拆解后,去除金屬、碳棒以及外包裝后;
②準確稱取固體粉末1.200 g;
③經過水浸…等步驟得到濾液1(<100 mL);
④將濾液1稀釋至100.00 mL;
⑤取20.00 mL溶液用0.0500 molL-1EDTA標準溶液滴定;在一定條件下,只發生反應:Mn2++Y2-=MnY。
⑥重復滴定3次,平均消耗標準溶液22.00 mL。
則Mn元素的質量百分數為________。(保留3位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A. 標準狀況下,22.4 L CCl4中含CCl4分子數為NA
B. 5.6 g鐵和6.4 g銅分別與0.1 mol氯氣完全反應,轉移的電子數相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-數為0.2NA
D. 3.9 g Na2O2 晶體中含有的離子總數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有機化合物的結構簡式可進一步簡化,如:
![]()
根據題目要求回答下列問題:
①有機物 ![]() 與氫氣發生化學反應的化學方程式為(用結構簡式書寫): _________________________________________,該有機化學反應的類型是____________。
與氫氣發生化學反應的化學方程式為(用結構簡式書寫): _________________________________________,該有機化學反應的類型是____________。
②β-月桂烯的結構簡式為![]() ,一分子該物質與兩分子溴發生加成反應的產物(只考慮位置異構)理論上最多有_________種。
,一分子該物質與兩分子溴發生加成反應的產物(只考慮位置異構)理論上最多有_________種。
(2)下列幾種烴類物質:

① 正四面體烷的二氯取代產物有__________種;立方烷的二氯取代產物有__________種。
② 關于苯和環辛四烯的說法正確的是___________(填字母符號)。
A 都能使酸性KMnO4溶液褪色
B 都能與H2發生加成反應,等質量的苯和環辛四烯消耗H2的物質的量之比為3:4
C 都是碳碳單鍵和碳碳雙鍵交替結構
D 都能發生氧化反應
(3)下圖是石蠟油在熾熱碎瓷片的作用下分解產生某種氣體,并驗證其性質的裝置:

回答下列問題:
① 該氣體可以衡量一個國家的石油化工生產水平,該氣體的結構簡式是___________。
② B中酸性高錳酸鉀溶液和C中溴的四氯化碳溶液都褪色,說明該氣體能被酸性高錳酸
鉀__________。在C中發生的化學反應方程式為________________________________,反應類型為_________。
③ 由乙炔可以制取甲苯,甲苯一溴代物的同分異構體有________種,其中對溴甲苯的結構
簡式為__________________。
④ 甲苯可用于制造烈性炸藥TNT,該反應的化學方程式為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1913年,德國化學家哈伯實現了合成氨的工業化生產,被稱作解救世界糧食危機的化學天才.現將lmolN2和3molH2投入1L的密閉容器,在一定條件下,利用如下反應模擬哈伯合成氨的工業化生產:N2(g)+3H2(g) ![]() 2NH3(g)△H<0.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.
2NH3(g)△H<0.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.

回答下列問題:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g) ![]() 2NH3(l)△H2;則反應N2(g)+3H2(g)
2NH3(l)△H2;則反應N2(g)+3H2(g) ![]() 2NH3(g)的△H=_____________(用含△H1、△H2的代數式表示);
2NH3(g)的△H=_____________(用含△H1、△H2的代數式表示);
(2)合成氨的平衡常數表達式為____________,平衡時,M點NH3的體積分數為10%,則N2的轉化率為____________(保留兩位有效數字) ;
(3)X軸上a點的數值比b點____________(填“大”或“小”)。上圖中,Y軸表示____________(填“溫度”或“壓強”),判斷的理由是____________;
(4)若將1mol N2和3mol H2分別投入起始容積為1L的密閉容器中,實驗條件和平衡時的相關數據如表所示:
容器編號 | 實驗條件 | 平衡時反應中的能量變化 |
Ⅰ | 恒溫恒容 | 放熱Q1kJ |
Ⅱ | 恒溫恒壓 | 放熱Q2kJ |
Ⅲ | 恒容絕熱 | 放熱Q3kJ |
下列判斷正確的是____________;
A.放出熱量:Ql<Q2<△Hl B.N2的轉化率:Ⅰ>Ⅲ
C.平衡常數:Ⅱ>Ⅰ D.達平衡時氨氣的體積分數:Ⅰ>Ⅱ
(5)常溫下,向VmL amol/L的稀硫酸溶液中滴加等體積bmol/L的氨水,恰好使混合溶液呈中性,此時溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”) ;
(6)利用氨氣設計一種環保燃料電池,一極通入氨氣,另一極通入空氣,電解質是摻雜氧化釔(Y2O3)的氧化鋯(ZrO2)晶體,它在熔融狀態下能傳導O2-,寫出負極的電極反應式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞顯紅色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水電離出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com