
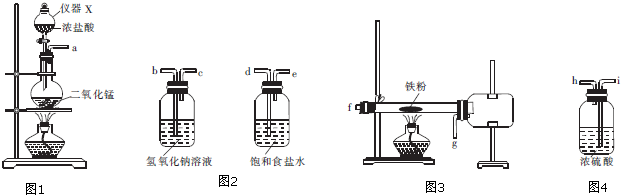
分析 (1)次氯酸根離子具有強的氧化性能夠氧化氯離子生成氯氣;
(2)①熟悉儀器構造,說出其名稱;
②利用生成的氯氣排出裝置中的空氣;
③制備無水三氯化鐵裝置連接順序:制備氯氣、除去氯化氫、干燥氯氣、制備氯化鐵、防止尾氣處理裝置中水蒸氣進入硬質試管、尾氣處理裝置,據此解答;
(3)氯化鐵氧化性若強于碘,則依據氧化性強弱規律可知,氯化鐵能夠氧化碘離子生成單質碘,碘遇到淀粉變藍,據此設計實驗.
解答 解:(1)次氯酸根離子具有強的氧化性能夠氧化氯離子生成氯氣,離子方程式:Cl0-+Cl-+2H+=Cl2+H2O,故答案為:Cl0-+Cl-+2H+=Cl2+H2O;
(2)①X是分液漏斗,故答案為:分液漏斗;
②硬質試管中的反應開始前,需排除裝置中的空氣,防止氧氣和鐵反應生成鐵的氧化物而產生雜質,所以硬質試管中的反應開始前,必須排除裝置中的空氣,其方法是制備氯氣的反應進行一段時間后,看到共綠色氣體充滿裝置,再開始加熱硬質試管,
故答案為:制備氯氣的反應進行一段時間后,看到共綠色氣體充滿裝置,再開始加熱硬質試管;
③制備無水三氯化鐵裝置連接順序:制備氯氣、除去氯化氫、干燥氯氣、制備氯化鐵、防止尾氣處理裝置中水蒸氣進入硬質試管、尾氣處理裝置,洗氣是應長進短出,所以正確的順序為:a→d→e→i→h→f→g→i→h→b;
故答案為:d→e→i→h→f→g→i→h→b;
(3)氯化鐵氧化性若強于碘,則依據氧化性強弱規律可知,氯化鐵能夠氧化碘離子生成單質碘,碘遇到淀粉變藍,所以要證明FeC13的氧化性比I2強,可以:在淀粉碘化鉀溶液中加入氯化鐵,溶液變藍說明氯化鐵氧化性強于碘;
故答案為:在淀粉碘化鉀溶液中加入氯化鐵,溶液變藍說明氯化鐵氧化性強于碘.
點評 本題以氯化鐵的制備為載體,考查了氯氣的制備和凈化、性質的檢驗,明確氯氣制備原理和氯氣的氧化性是解題關鍵,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 有單質鐵生成 | B. | 有氣泡產生、最終有白色沉淀生成 | ||
| C. | 氧化劑只有H20 | D. | 被氧化的元素有鈉、鐵兩種元素. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Y>X | |
| B. | 元素X與M形成的化合物的空間構型可能是正四面體、直線型或平面型 | |
| C. | 將XZ2通入W單質與水反應后的溶液中,生成的鹽一定只有一種 | |
| D. | 由Z、M兩種種元素形成的化合物一定只有極性共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃時①10-3mol/L的鹽酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的電離程度為:②>③>① | |
| C. | 圖中a點溶液中各離子濃度的關系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 圖中pH=7時c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體粒子帶電荷并且在一定條件下能穩定存在Ba2+,Cu2+,Ag+溶液沉淀1溶液沉淀3+C+B+A沉淀2 | |
| B. | 膠體的分散質粒子直徑在1 nm~100nm之間 | |
| C. | 膠體粒子不能穿過半透膜,能通過濾紙空隙 | |
| D. | 膠體粒子能夠發生布朗運動而且能產生丁達爾現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
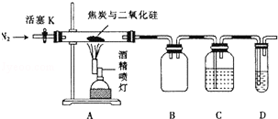 某實驗小組設計了如下裝置對焦炭還原二氧化硅的氣體產物的成分進行探究.
某實驗小組設計了如下裝置對焦炭還原二氧化硅的氣體產物的成分進行探究.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
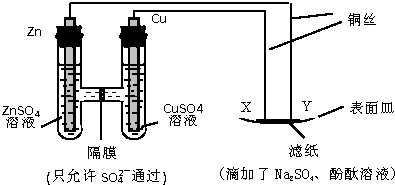
| A. | Y 與濾紙接觸處有氧氣生成 | B. | X 為正極,發生氧化反應 | ||
| C. | Y 為陰極,發生還原反應 | D. | X 與濾紙接觸處變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
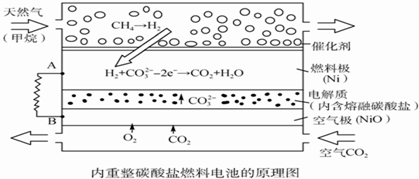
| A. | 以此電池為電源電解精煉銅,當有0.1 mol e-轉移時,有3.2 g銅溶解 | |
| B. | 若以甲烷為燃料氣時負極電極反應式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 該電池使用過程中需補充Li2CO3和K2CO3 | |
| D. | 空氣極發生的電極反應式為O2+4e-+2CO2═2CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com