
【題目】某強酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一種或幾種離子,取該溶液進行實驗,轉化關系如圖所示。反應過程中有一種氣體在空氣中會變為紅棕色。回答下列問題:
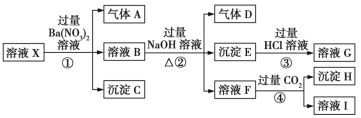
(1)沉淀C是___(填化學式),由此可確定溶液X中肯定不存在的陽離子有___。
(2)氣體A是___(填化學式),產生氣體A的離子方程式為___。
(3)步驟④中發生反應的離子方程式為___。
(4)根據題給信息和圖中轉化關系,可以確定溶液X中肯定存在的離子有___,可能存在的離子有___。
【答案】BaSO4 Ba2+ NO 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Al3+、NH4+、SO42-、Fe2+ Fe3+
【解析】
①溶液X為強酸性,則溶液中不存在弱酸根離子CO32-、SiO32-,溶液X和硝酸鋇溶液反應生成沉淀C,則溶液X中存在SO42-,不存在和硫酸根離子反應的Ba2+,沉淀C是BaSO4;
②酸性條件下硝酸根離子具有強氧化性,溶液中Fe2+和NO3-不能共存,加入硝酸鋇產生氣體,在空氣中會變為紅棕色,則溶液中存在Fe2+、不存在NO3-,氣體A是NO;
③溶液B中加入氫氧化鈉溶液、加熱時,產生氣體D,則溶液中含有NH4+,D是NH3,產生沉淀E,則E中含有Fe(OH)2,可能含有Fe(OH)3;
④溶液F中通入過量CO2生成沉淀H,則溶液X中含有Al3+;
綜上,強酸性溶液X中:溶液X中肯定不存在的離子有CO32-、SiO32-、NO3-、Ba2+,肯定存在的離子有Al3+、NH4+、Fe2+、SO42-,可能存在的離子為Fe3+。
(1)溶液X為強酸性,則溶液中不存在弱酸根離子CO32-、SiO32-,溶液X和硝酸鋇溶液反應生成沉淀C,則溶液X中存在SO42-,不存在和硫酸根離子反應的Ba2+,沉淀C是BaSO4;
(2)酸性條件下硝酸根離子具有強氧化性,加入硝酸鋇產生氣體,在空氣中會變為紅棕色,則溶液中存在Fe2+、不存在NO3-,氣體A是NO,反應的離子方程式為3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(3)溶液F中通入過量CO2生成沉淀H,步驟④中發生反應的離子方程式為AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(4)根據題給信息和圖中轉化關系,強酸性溶液X中:溶液X中肯定不存在的離子有CO32-、SiO32-、NO3-、Ba2+,肯定存在的離子有Al3+、NH4+、Fe2+、SO42-,可能存在的離子為Fe3+。


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案科目:高中化學 來源: 題型:
【題目】有![]() 、
、![]() 、
、![]() 三種短周期元素,其原子半徑的大小順序為
三種短周期元素,其原子半徑的大小順序為![]() ,原子序數之和為16。三種元素的常見單質在適當條件下可發生如圖所示的反應,其中
,原子序數之和為16。三種元素的常見單質在適當條件下可發生如圖所示的反應,其中![]() 為
為![]() 、
、![]() 組成的雙原子分子,
組成的雙原子分子,![]() 和
和![]() 均為10電子分子。下列判斷錯誤的是( )
均為10電子分子。下列判斷錯誤的是( )
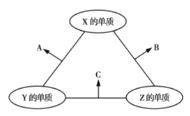
A.![]() 的最外層電子數為6
的最外層電子數為6
B.![]() 和
和![]() 之間不可能發生氧化還原反應
之間不可能發生氧化還原反應
C.![]() 的沸點高于
的沸點高于![]() 的沸點
的沸點
D.![]() 不能溶于
不能溶于![]() 中
中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五種短周期元素X、Y、Z、L、M,原子序數依次遞增。X是原子半徑最小的元素,Y的最高正價和最低負價的代數和為0,Z的氣態氫化物和它的最高價氧化物對應的水化物能發生化合反應,L的最外層電子數是次外層的3倍,M是地殼中含量最高的金屬元素。
回答下列問題:
(1)五種元素的原子半徑從大到小的順序是______(用元素符號表示)。
(2)X能分別與Y、Z、L形成具有相同電子數的化合物A、B、C。實驗室制取B的化學方程式為______。
(3)Z的最高價氧化物對應水化物與M的最高價氧化物對應水化物反應的離子方程式為_______。
(4)硒(Se)是人體必需的微量元素,與L同一主族,Se原子比L原子多兩個電子層,則Se的原子序數為_______,其最高價氧化物對應的水化物化學式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定條件下,將NO2與SO2以體積比1:2置于密閉容器中發生上述反應,測得平衡時NO2與SO2體積比為1:6,則平衡常數K=______。
(2)一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根據題意完成下列各小題:
CH3OH(g)。根據題意完成下列各小題:
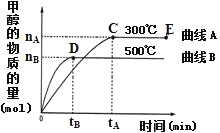
①反應達到平衡時,平衡常數表達式K=______。
②在500℃,從反應開始到平衡,氫氣的平均反應速率v(H2)=_____。(用圖中出現的字母表示)
③甲醇—空氣燃料電池是一種環境友好型堿性電池,該電池放電時,負極的反應式為_____。
④甲醇是未來的重要的能源物質,常溫下,1g甲醇液體完全燃燒生成液態水時放出22.7kJ的能量,寫出甲醇燃燒熱的熱化學方程式_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業催化劑 K3[Fe(C2O4)3]·3H2O是翠綠色晶體,在421~553℃時,分解為Fe2O3、K2CO3、CO、CO2、H2O。實驗室由草酸亞鐵晶體(FeC2O4·H2O)、草酸鉀(K2C2O4)、草酸(H2C2O4)和雙氧水(H2O2)混合制備。請回答下列問題
(1)寫出H2O2的電子式:___。
(2)配平該方程式:__FeC2O4·2H2O+__H2O2+__K2C2O4+__H2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制備過程中要防止草酸被H2O2氧化,請寫出草酸被H2O2氧化的化學反應方程式___;
(4)配合物的穩定性可以用穩定常數K來衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其穩定常數表達式為:K=![]() 。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液檢驗K3[Fe(C2O4)3]·3H2O中的鐵元素?___(填“是”或“否”)若選“否”,請設計檢驗鐵元素的方案___。
103,能否用KSCN溶液檢驗K3[Fe(C2O4)3]·3H2O中的鐵元素?___(填“是”或“否”)若選“否”,請設計檢驗鐵元素的方案___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求完成下列問題:
![]()
(1)A、B、C之間有如圖的轉化關系,若A為AlCl3,寫出A和C反應的離子方程式:_______________;
(2)檢驗Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震蕩后靜置,然后取上層清液于試管中,再加入幾滴b溶液,產生白色沉淀。試劑a、b分別是_____________ 、_______________
(3)已知H2、CO的燃燒熱分別是akJ∕mol、bkJ∕mol,1mol液態水變為氣態水吸收ckJ熱量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,寫出碳(C)燃燒的熱化學方程式____________________。
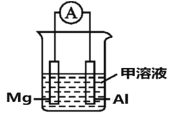
(4)Mg、Al設計成如圖所示原電池裝置:若電解液為鹽酸,正極的電極反應為__________。若電解液為氫氧化鈉溶液,負極的電極反應為________________。
(5)寫出用氫氧化鉀做電解質溶液,甲醇(CH3OH)為燃料的負極的電極反應:__________________。
(6)若鉛蓄電池負極質量增加19.2g,則其正極質量增加____________ g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于元素周期表中下列位置的①~⑩10種元素,請用元素符號或化學式回答有關問題:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | ② | ||||||
二 | ③ | ④ | ⑤ | ⑥ | ||||
三 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑦在元素周期表中的位置____________。
(2)以上元素所形成的最高價含氧酸酸性最強的酸是____________,(填化學式,下同)堿性最強的堿是____________。它們與⑨的單質反應的離子方程式分別為____________、____________。
(3)④⑤⑥的原子半徑的由大到小順序為____________。(填元素符號)③④⑤⑥的最簡單氫化物的穩定性由弱到強的順序為____________。
(4)⑤⑦的一種1:1型化合物X的電子式為____________。X能和①⑤組成的一種化合物Y反應生成⑤的單子,則化學方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫時,CaCO3在水中的沉淀溶解平衡曲線如圖所示。已知CaCO3的溶度積(室溫)為2.8×10-9,下列說法中不正確的是

A. x的數值為2×10-5
B. c點時有CaCO3生成
C. 加入蒸餾水可使溶液由d點變成 a點
D. b點與d點對應的溶度積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某氣體反應的平衡常數可表示為K=c(CH3OCH3)c(H2O)/c2(CH3OH),該反應在不同溫度下的平衡常數:400℃,K=32;500℃,K=44。請回答下列問題:
(1)寫出上述反應的化學方程式:_________________________________ 。
(2)該反應的△H _________0。
(3)已知在密閉容器中,測得某時刻各組分的濃度如下:
物質 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
濃度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此時溫度400℃,則某時刻υ正_______υ逆(填<、>或=,下同)。
②若以溫度為橫坐標,以該溫度下平衡態甲醇物質的量n為縱坐標,此時反應點在圖象的位置是圖中____點,比較圖中B、D兩點所對應的正反應速率υB_______υD,理由是____。

(4)一定條件下要提高反應物的轉化率,可以采用的措施是___________。
a.升高溫度 b.加入催化劑 c.壓縮容器的體積
d.增加水蒸氣的濃度 e.及時分離出產物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com