
【題目】有![]() 、
、![]() 、
、![]() 三種短周期元素,其原子半徑的大小順序為
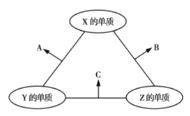
三種短周期元素,其原子半徑的大小順序為![]() ,原子序數之和為16。三種元素的常見單質在適當條件下可發生如圖所示的反應,其中
,原子序數之和為16。三種元素的常見單質在適當條件下可發生如圖所示的反應,其中![]() 為
為![]() 、
、![]() 組成的雙原子分子,
組成的雙原子分子,![]() 和
和![]() 均為10電子分子。下列判斷錯誤的是( )
均為10電子分子。下列判斷錯誤的是( )
A.![]() 的最外層電子數為6
的最外層電子數為6
B.![]() 和
和![]() 之間不可能發生氧化還原反應
之間不可能發生氧化還原反應
C.![]() 的沸點高于
的沸點高于![]() 的沸點
的沸點
D.![]() 不能溶于
不能溶于![]() 中
中
【答案】B
【解析】
B和C均為10電子分子,考慮為氫化物,由轉化關系可知,Z為氫,X、Y、Z原子序數之和為16,則X、Y的原子序數之和為15,原子半徑Y>X,則Y為碳元素、X為氟元素或者Y為氮元素、X為氧元素,由轉化關系,單質X、Y反應生成A,單質X、Z生成B,則Y應為氮元素、X應為氧元素,則A為NO、B為H2O、C為NH3,驗證符合轉化關系。
A. X為氧元素,屬于主族元素,最外層電子數為6,處于ⅥA族,故A正確;
B. 氨氣與NO可以發生反應生成氮氣與水,屬于氧化還原反應,故B錯誤;
C. 常溫下,水為液體,氨氣為氣態,水的沸點更高,故C正確;
D. NO不溶于水,故D正確;
故選B。


 優等生題庫系列答案
優等生題庫系列答案 53天天練系列答案
53天天練系列答案科目:高中化學 來源: 題型:
【題目】將MnO2與FeSO4溶液、硫酸充分反應后過濾,將濾液加熱至60℃后,再加入Na2CO3溶液,最終可制得堿式碳酸錳[aMnCO3·bMn(OH)2·cH2O]。
(1)用廢鐵屑與硫酸反應制備FeSO4溶液時,所用鐵屑需比理論值略高,原因是 ,反應前需將廢鐵屑用熱Na2CO3溶液浸泡,其目的是 。
(2)為測定堿式碳酸錳組成,取7.390 g樣品溶于硫酸,生成CO2 224.0 mL(標準狀況),并配成500 mL溶液。準確量取10.00 mL該溶液,用0.0500 mol·L-1 EDTA(化學式Na2H2Y)標準溶液滴定其中的Mn2+(原理為Mn2+ +H2Y2-=MnY2-+2H+),至終點時消耗EDTA標準溶液28.00 mL。通過計算確定該樣品的化學式。(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年10月9日,瑞典皇家科學院宣布2019年度諾貝爾化學獎授予在鋰離子電池的發展方面做出貢獻的科學家。某高能![]() 電池,多應用于公共交通。電池工作時結構如圖所示,電池中間是聚合物的隔膜,主要作用是在反應過程中只讓
電池,多應用于公共交通。電池工作時結構如圖所示,電池中間是聚合物的隔膜,主要作用是在反應過程中只讓![]() 通過,電池工作時總反應可以表示為:
通過,電池工作時總反應可以表示為:![]() 。下列說法不正確( )
。下列說法不正確( )
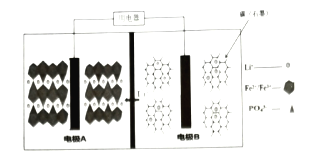
A.電池工作時,電極B為負極
B.充電時,電極A上的電勢比電極B上的高
C.電池工作時,A極電極反應式:![]()
D.充電時,以鉛蓄電池為電源,則電極A與![]() 電極相連
電極相連
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,將3 mol A氣體和1 mol B氣體混合于固定容積為2 L的密閉容器中,發生反應:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )
C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )

A. 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態
B. 2 min后,加壓會使正反應速率加快,逆反應速率變慢
C. 反應過程中A和B的轉化率之比為3∶1
D. 開始到平衡,用A表示的化學反應速率為0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分短周期元素的原子半徑及主要化合價如下表:
元素 |
|
|
|
|
|
原子半徑/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合價 | +2 | +1 | +2 | +6、-2 | -2 |
下列敘述正確的是( )
A.![]() 一定是金屬元素
一定是金屬元素
B.原子半徑大小:![]()
C.![]() 的簡單氫化物的沸點比
的簡單氫化物的沸點比![]() 的大
的大
D.![]() 、
、![]() 可能形成陰、陽離子個數比為
可能形成陰、陽離子個數比為![]() 的兩種化合物
的兩種化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以海水為電解質的Mg-AgCl電池在軍事上可用作電動魚雷的電源,其電池反應離子方程式為:2AgCl+Mg=Mg2++2Ag+2Cl-。該電池工作時,下列說法正確的是( )

A.正、負極的質量均減少
B.電子由AgCl經外電路流向Mg
C.AgCl電極發生氧化反應
D.該裝置實現了電能向化學能的轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水約占地球表面積的71%,具有十分巨大的開發潛力。下圖是開水資源綜合利用的工藝圖,以下說法正確( )

A. 電解NaCl溶液時可用鐵做電極,其離子方程式為:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦鹵中加入Cl2的作用是置換出溴單質,該過程體現了還原性:Cl- > Br-
C. 實驗室模擬海水提取淡水,除夾持裝置外只用到的儀器有蒸餾燒瓶、酒精燈、錐形瓶
D. Br2 與SO2的水溶液發生反應的離子方程式為:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸銅是制備Cu—Zn—Al系催化劑的重要原料,制取硝酸銅現有三種設計方案可供選用:①Cu與稀硝酸反應制取,②Cu與濃硝酸反應制取,③通氧氣于銅屑與稀硝酸的體系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O。下列說法正確的是( )
A.制取相同量的硝酸銅需硝酸的量③最多
B.制取相同量的硝酸銅①產生的有毒氣體比②多
C.三種方案中硝酸的利用率③>①>②
D.三種方案的反應都可以在鐵制容器中進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一種或幾種離子,取該溶液進行實驗,轉化關系如圖所示。反應過程中有一種氣體在空氣中會變為紅棕色。回答下列問題:
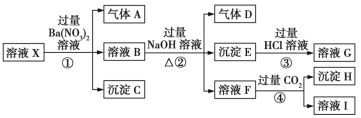
(1)沉淀C是___(填化學式),由此可確定溶液X中肯定不存在的陽離子有___。
(2)氣體A是___(填化學式),產生氣體A的離子方程式為___。
(3)步驟④中發生反應的離子方程式為___。
(4)根據題給信息和圖中轉化關系,可以確定溶液X中肯定存在的離子有___,可能存在的離子有___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com