
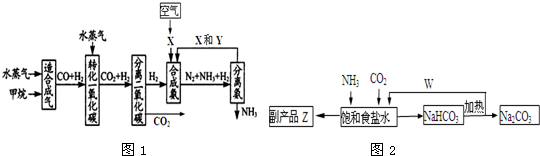
分析 水蒸氣和甲烷生成一氧化碳和氫氣,一氧化碳和氫氣氣體通過水蒸氣轉化為二氧化碳和氫氣,利用空氣制備氮氣,氫氣和氮氣合成氨,分離出氨氣促進平衡正向進行,提高氨氣的產率,循環使用氮氣和氫氣的混合氣體,提高原料利用率;
在聯合制堿法中,合成氨產生的NH3與CO2通入飽和食鹽水,發生反應NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3,過濾得到碳酸氫鈉晶體,濾液為副產品氯化銨溶液,碳酸氫鈉分解最終可制得純堿,氯化銨可以提純后制的氮肥,
(1)2mol甲烷和0.5mol水蒸氣完全反應生成一氧化碳和氫氣(合成氣),吸收了a kJ熱量,則反應物各1mol完全反應吸收$\frac{a}{2}$KJ熱量,結合熱化學方程式書寫方法寫出熱化學方程式;
(2)依據分析可知,合成氨是氮氣和氫氣在催化劑作用下高溫高壓反應生成氨氣,用K2CO3溶液吸收分離出的CO2生成碳酸氫鈉;
(3)將生成的氨從混合氣體中及時分離出來,促進平衡正向進行,增大氨氣的產量;
(4)①二氧化碳在水溶液中溶解度小,先通氨氣,使溶液呈堿性,有利于二氧化碳的溶解,反應的副產品氯化銨可作農業生產的化肥;
②反應的化學方程式為:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,依據定量關系計算副產品氯化銨的質量.
解答 解:(1)2mol甲烷和0.5mol水蒸氣完全反應生成一氧化碳和氫氣(合成氣),吸收了a kJ熱量,則反應物各1mol完全反應吸收$\frac{a}{2}$KJ熱量,結合熱化學方程式書寫方法寫出熱化學方程式:CH4(g)+H2O (g)═CO(g)+3H2(g)△H=+1/2a kJ/mol,
故答案為:CH4(g)+H2O (g)═CO(g)+3H2(g)△H=+$\frac{a}{2}$ kJ/mol;
(2)依據分析可知,合成氨是氮氣和氫氣在催化劑作用下高溫高壓反應生成氨氣,圖1中X為N2,Y為H2,用K2CO3溶液吸收分離出的CO2生成碳酸氫鈉,反應的離子方程式為:CO3-+CO2+H2O=2HCO3-,
故答案為:N2;H2; CO3-+CO2+H2O=2HCO3-;
(3)將生成的氨從混合氣體中及時分離出來,減少生成物的濃度促進平衡正向進行,增大氨氣的產量,
故答案為:減小生成物濃度,促進平衡正向移動;
(4)①二氧化碳在水溶液中溶解度小,先通氨氣使溶液呈堿性,有利于二氧化碳的溶解,反應的化學方程式為:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3,聯合制堿法中,合成氨產生的NH3與CO2通入飽和食鹽水最終可制得純堿,副產品氯化銨可作農業生產的化肥,W為碳酸氫鈉分解生成的二氧化碳氣體,通入飽和食鹽水循環使用,
故答案為:NH3,NH4Cl,氮肥,CO2;
②NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
得到 2NH4Cl~Na2CO3
2×53.5 106
m 5.3t
m=5.35t
故答案為:5.35.
點評 本題考查了學生對工藝流程的理解,熱化學方程式,物質的分離等,難度中等,關鍵是掌握整個制備流程原理,要求學生要有扎實的基礎知識和靈活應用知識解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 加熱 溶解 過濾 結晶 | B. | 溶解 過濾 蒸發 結晶 | ||
| C. | 加熱 溶解 蒸發 過濾 | D. | 溶解 過濾 蒸餾 蒸發 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
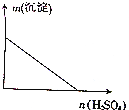 向某分散系中逐滴加入硫酸,測得溶液中沉淀的質量與加入硫酸的物質的量的關系如圖所示,則該分散系可能是( )
向某分散系中逐滴加入硫酸,測得溶液中沉淀的質量與加入硫酸的物質的量的關系如圖所示,則該分散系可能是( )| A. | 硝酸鈣與硫酸鉀的混合液 | B. | 氯化鋇與碳酸鈉的混合液 | ||
| C. | 硫酸鎂與氫氧化鉀的混合液 | D. | 氯化鋁與硝酸鈉的混合液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 先通二氧化碳、后通氨氣、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循環使用 | D. | 往甲中通CO2有利于制備(NH4)2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)根據最新“人工固氮”的研究報道,在常溫常壓和光照條件下N2在催化劑表面與水發生反應:
(1)根據最新“人工固氮”的研究報道,在常溫常壓和光照條件下N2在催化劑表面與水發生反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間濃度(mol/L)溫度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗步驟 | 現象 | 結論 |
| ①分別取等體積的 2 mol/L的硫酸于試管 | 反應速率:鎂>鐵,銅不反應 | 金屬的性質越活潑,反應速率越快 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com