
 硫酸廠用煅燒黃鐵礦(FeS2)來制取硫酸,實驗室利用硫酸廠燒渣(主要成分是Fe2O3及少量FeS、SiO2)制備綠礬.
硫酸廠用煅燒黃鐵礦(FeS2)來制取硫酸,實驗室利用硫酸廠燒渣(主要成分是Fe2O3及少量FeS、SiO2)制備綠礬.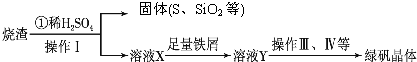
分析 (1)①根據平衡常數的表達式公式寫出該反應的平衡常數表達式;
②根據達到平衡狀態,正逆反應速率相等,各組分的濃度不變進行判斷;
(2)①根據原電池工作原理分析負極、正極發生的反應;
②根據電流方向判斷氫離子的移動方向;反應原理為二氧化硫、氧氣和水反應生成硫酸;
(3)①根據在酸性條件下反應,反應物一定有氫離子,然后根據電子守恒和質量守恒配平方程式;
②根據反應結束時滴入高錳酸鉀溶液溶液后顏色變化判斷滴定終點;
③根據反應方程式及高錳酸鉀的物質的量計算出產品中FeSO4•7H2O的質量分數.
解答 解:(1)A.v(SO2)=v(SO3),沒有告訴正逆反應,無法判斷正逆反應速率是否相等,故A錯誤;
B.反應方程式兩邊都是氣體,氣體的化學計量數之和不相等,氣體的平均相對分子量是個變化的量,混合物的平均相對分子質量不變,說明正逆反應速率相等,達到了平衡狀態,故B正確;
C.反應方程式兩邊都是氣體,氣體的質量始終不變,所以混合氣體質量不變,不能判斷是否達到平衡狀態,故C錯誤;
D、各組分的體積分數不變,正逆反應速率相等,說明達到了平衡狀態,故D正確;
故選:BD;
(2)①該原電池中,負極上失電子被氧化,所以負極上投放的氣體是二氧化硫,二氧化硫失電子和水反應生成硫酸根離子和氫離子,正極上投放的氣體是氧氣,正極上氧氣得電子和氫離子反應生成水,根據硫酸和水的出口方向知,B極是負極,A極是正極,所以B極上的電極反應式為:SO2-2e-+2H2O═SO42-+4H+,
故答案為:SO2-2e-+2H2O═SO42-+4H+;
②原電池放電時,氫離子由負極B移向正極A,電池總反應式為:2SO2+O2+2H2O═2H2SO4,
故答案為:B;A;2SO2+O2+2H2O═2H2SO4;
(3)①用硫酸酸化的0.01mol/L KMnO4溶液,所以反應物中一定有氫離子,高錳酸根離子化合價由+7變為+2,降低了5價,亞鐵離子與+2變為+3,升高了1價,所以高錳酸根離子系數為1、亞鐵離子系數為5,根據電荷守恒、質量守恒配平氫離子、水,配平后的方程式為:5Fe2++1MnO4-+8H+═5Fe3++1Mn2++4H2O,
故答案為:5;1;8;H+;5;1;4;H2O;
②當亞鐵離子與高錳酸鉀離子完全反應后,再滴入一滴高錳酸鉀溶液,溶液會呈淡紫色,據此判斷滴定終點,
故答案為:滴定最后一滴酸性KMnO4時溶液呈淡紫色,半分鐘內不褪色;
③25mL待測液消耗的高錳酸鉀的物質的量為:0.01mol/L×0.04L=0.0004mol,
5.7g產品配成250mL溶液消耗高錳酸鉀的物質的量為0.0004mol×$\frac{250}{25}$=0.004mol,
根據反應:5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亞鐵的物質的量為:0.004mol×5=0.02mol,
所以樣品中含有的FeSO4•7H2O的質量為:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的質量分數為:$\frac{5.56g}{5.7g}$×100%≈97.5%,
故答案為:0.975或97.5%.
點評 本題所以黃銅礦為載體考查化學平衡常數及平衡狀態的判斷、燃料電池、氧化還原反應及滴定的相關知識,涉及的題量較大,難度稍大.


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:填空題
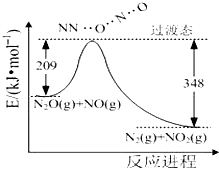 氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 LH2O含有的分子數為NA | |
| B. | 1molAl3+離子含有的核外電子數為3NA | |
| C. | 3mol Fe在高溫下與足量的水蒸汽反應轉移的電子數為8NA | |
| D. | 1molNa2O2與足量的水反應失去電子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 生成氯氣的相對分子質量為71 | B. | 生成1 mol氯化鉀轉移5 NA個電子 | ||
| C. | 生成氯化鉀的摩爾質量為76 g/mol | D. | 1molH37Cl參加反應轉移NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用催化劑是為了加快反應速率,提高生產效率 | |
| B. | 向該體系中充入18O2,一段時間后18O只存在于SO3中 | |
| C. | 生成物的總能量大于反應物的總能量 | |
| D. | 將該反應設計成原電池,放出的熱量不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
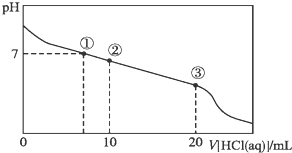
| A. | 點①所示溶液中,溶質為未反應完的CH3COONa、生成的CH3COOH和NaCl,微粒之間的關系為:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 點②所示溶液中,醋酸鈉有一半與鹽酸反應,微粒之間的關系為:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 點③所示溶液中,醋酸鈉與鹽酸恰好完全反應,微粒之間的關系為:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整個過程中有可能出現:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
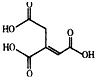
| A. | 化學式為C6H6O6 | |
| B. | 烏頭酸能發生水解反應和加成反應 | |
| C. | 烏頭酸能使酸性高錳酸鉀溶液褪色 | |
| D. | 含1mol烏頭酸的溶液最多可消耗3molNaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 減壓 | B. | 加壓 | C. | 適當降溫 | D. | 升高溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{2}$(10-9+10-11)mol/L | B. | 2×10-11 mol/L | ||
| C. | (10-9+10-11)mol/L | D. | $\frac{1}{2}$(10-5+10-3)mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com