
 ,1mol戊與過量鹽酸反應的離子方程式是N2H4+2H+═N2H62+ 戊在氧化還原反應中與H2O2相似,既可作氧化劑,又可作還原劑,根據價態分析產生這種情況的原因是N2H4中氮元素的化合價為-2價,既可以升高,又可以降低;8g液態戊與液態雙氧水恰好完全反應,產生兩種無毒又不污染環境的氣態物質,放出375kJ的熱量,寫出該反應的熱化學方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
,1mol戊與過量鹽酸反應的離子方程式是N2H4+2H+═N2H62+ 戊在氧化還原反應中與H2O2相似,既可作氧化劑,又可作還原劑,根據價態分析產生這種情況的原因是N2H4中氮元素的化合價為-2價,既可以升高,又可以降低;8g液態戊與液態雙氧水恰好完全反應,產生兩種無毒又不污染環境的氣態物質,放出375kJ的熱量,寫出該反應的熱化學方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol. 分析 A、B、C、D、E為元素周期表中前三周期元素形成的五種離子,A、B、C、D四種離子的電子數均比E(雙核18電子離子)的電子數少8,A、B、C、D四種離子均為10電子.
(1)A與B結合成的化合物甲中既有離子鍵又有共價鍵,A與C結合成的化合物乙難溶于水,乙溶于甲的水溶液得無色透明溶液,則A為OH-,B為Na+、C為Al3+,甲為NaOH,乙為Al(OH)3;
(2)B與E結合成化合物丙,其中離子數之比為2:1,A與D結合成化合物丁,丁與丙反應產生無色無味的氣體,則為E為O22-,丙為Na2O2,D為H3O+,丁為H2O;
(3)有一種液態氮氫化合物戊,分子中氮與氫兩種元素的質量比為7:1,分子中N、H原子數目之比為$\frac{7}{14}$:$\frac{1}{1}$=2:1,與E的電子數相同,則戊為N2H4.
解答 解:A、B、C、D、E為元素周期表中前三周期元素形成的五種離子,A、B、C、D四種離子的電子數均比E(雙核18電子離子)的電子數少8,A、B、C、D四種離子均為10電子.
(1)A與B結合成的化合物甲中既有離子鍵又有共價鍵,A與C結合成的化合物乙難溶于水,乙溶于甲的水溶液得無色透明溶液,則A為OH-,B為Na+、C為Al3+,甲為NaOH,乙為Al(OH)3,Al在周期表中位置為:第三周期ⅢA族,乙與甲的水溶液反應的離子方程式為:Al(OH)3+OH-═AlO2-+2H2O,
故答案為:第三周期ⅢA族;Al(OH)3+OH-═AlO2-+2H2O;
(2)B與E結合成化合物丙,其中離子數之比為2:1,A與D結合成化合物丁,丁與丙反應產生無色無味的氣體,則為E為O22-,丙為Na2O2,D為H3O+,丁為H2O,丁與丙反應的化學方程式為:2Na2O2+2H2O═4NaOH+O2↑,
故答案為:2Na2O2+2H2O═4NaOH+O2↑;
(3)有一種液態氮氫化合物戊,分子中氮與氫兩種元素的質量比為7:1,分子中N、H原子數目之比為$\frac{7}{14}$:$\frac{1}{1}$=2:1,與E的電子數相同,則戊為N2H4,該分子結構中只有單鍵,與氨相似,則N原子之間形成1對共用電子對,N原子與H原子之間形成1對共用電子對,其結構式為: ,與足量鹽酸反應離子方程式為:N2H4+2H+═N2H62+;
,與足量鹽酸反應離子方程式為:N2H4+2H+═N2H62+;
N2H4中氮元素的化合價為-2價,既可以升高,又可以降低,既可作氧化劑,又可作還原劑;
液態戊與液態雙氧水恰好完全反應,產生兩種無毒又不污染環境的氣態物質,應生成氮氣與水,8gN2H4的物質的量為$\frac{8g}{32g/mol}$=0.25mol,1molN2H4反應放出的熱量為375kJ×$\frac{1mol}{0.25mol}$=1500kJ,反應熱化學方程式為:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol,
故答案為: ;N2H4+2H+═N2H62+;N2H4中氮元素的化合價為-2價,既可以升高,又可以降低;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
;N2H4+2H+═N2H62+;N2H4中氮元素的化合價為-2價,既可以升高,又可以降低;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
點評 本題考查無機物推斷,需要學生熟練掌握常見10電子、18電子微粒,熟練掌握常見元素化合物性質,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
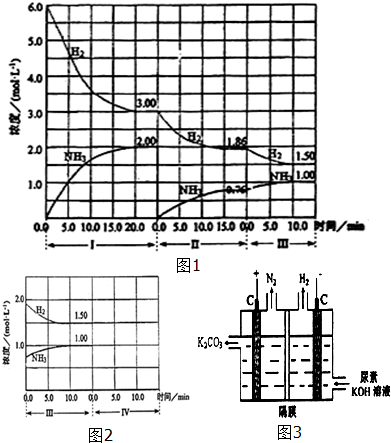
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
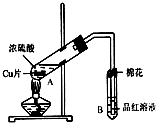 某研究小組用如圖所示裝置進行銅與濃硫酸反應的實驗研究.
某研究小組用如圖所示裝置進行銅與濃硫酸反應的實驗研究.| 坩堝質量 | 坩堝與晶體的總質量 | 加熱后坩堝與固體總質量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H、D、T互為同素異形體 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的電子式: | D. | 羥基的電子式: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲苯能使酸性高錳酸鉀溶液褪色,而甲烷不能使酸性高錳酸鉀溶液褪色 | |
| B. | 乙醛能與氫氣加成,而乙酸不能與氫氣加成 | |
| C. | 乙醇能與金屬鈉反應,而甲醚不能與金屬鈉反應 | |
| D. | 苯酚能與NaOH溶液反應,而乙醇不能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉與水反應:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸鈉溶液與醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,產生氣體:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 濃硝酸中加入過量鐵粉并加熱:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 與稀H2SO4共熱,生成2種有機物 | |
| B. | 該有機物的分子式為C14H10O9 | |
| C. | 常溫下,能與NaHCO3溶液反應放出CO2 | |
| D. | 能發生堿性水解反應,1mol該有機物完全反應消耗掉8molNaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com