
| A. | 稀H2SO4和稀Ba(OH)2溶液反應的熱化學方程式為:$\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3kJ/mol | |
| B. | 1molCO(g)完全燃燒時放熱283.0kJ,則2CO2(g)=2CO(g)+O2(g)反應的△H=+566kJ/mol | |
| C. | 需要加熱才能發生的反應一定是吸熱反應 | |
| D. | NaOH溶液與稀H2SO4反應中和熱的化學方程式為2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol |
分析 A.H2SO4和Ba(OH)2反應生成硫酸鋇沉淀,生成硫酸鋇的反應也放熱;
B.2molCO完全燃燒放出566kJ的熱量,結合蓋斯定律判斷;
C.反應熱與反應條件沒有必然關系;
D.中和熱的熱化學方程式中,水的計量數必須為1.
解答 解:A.H2SO4和Ca(OH)2反應生成硫酸鈣沉淀,不僅僅生成水,放出更多的熱量,則$\frac{1}{2}$H2SO4(aq)和$\frac{1}{2}$Ba(OH)2反應的中和熱△H<-57.3kJ/mol,故A錯誤;
B.CO(g)的燃燒熱是283.0kJ/mol,則CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol,根據蓋斯定律可知2CO2(g)=2CO(g)+O2(g)的反應熱為△H=+2×283.0kJ/mol,故B正確;
C.需要加熱才能發生的反應不一定是吸熱反應,如氫氣燃燒、鋁熱反應等為放熱反應,需要加熱才能進行,故C錯誤;
D.NaOH溶液與稀H2SO4反應生成硫酸鈉和水,該中和熱的化學方程式為:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-114.6kJ/mol,故D錯誤;
故選B.
點評 本題考查了熱化學方程式的書寫方法及表示意義,題目難度中等,明確燃燒熱、中和熱的概念為解答關鍵,注意掌握熱化學方程式的書寫原則,試題側重考查學生的分析能力及靈活應用基礎知識的能力.


 仁愛英語同步練習冊系列答案
仁愛英語同步練習冊系列答案 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:選擇題
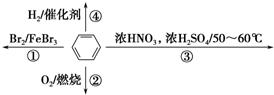
| A. | 反應①為取代反應,有機產物浮在上層 | |
| B. | 反應②為氧化反應,反應現象是火焰明亮并伴有濃煙 | |
| C. | 反應③為取代反應,只生成一種產物 | |
| D. | 反應④中1 mol苯最多與3 mol H2發生加成反應,因為苯分子含有3個碳碳雙鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.6g由NO2與N2O4組成的混合物中含有的N原子數為0.1NA | |
| B. | 40mL 10mol/L的濃HNO3與足量的Cu反應產生NO2分子數為0.2NA | |
| C. | 標準狀況下,6.72LSO3中,含有的原子數目為0.3NA | |
| D. | 1L 0.1mol/L的氨水中含有的NH4+數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 海水中最豐富的資源是食鹽 | |
| B. | 現代社會絕大部分食鹽用于食用 | |
| C. | 古代我國就在海灘曬鹽,這稱為鹽田法 | |
| D. | 目前我國海鹽年產量名列世界第一 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH | B. | C2H5OH | C. | HO-CH2CH2-OH | D. | CH3CH2CH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 普通鹽酸的酸性太強 | |
| B. | 普通鹽酸具有揮發性 | |
| C. | 普通鹽酸和月球巖石中的碳化物無法反應 | |
| D. | 無法區別巖石中原來含有的是碳化物,還是碳氫化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將容器體積變為20 L,Z的平衡濃度變為原來的1/2 | |
| B. | 以X的反應速率為0.001 mol•L-1•s-1 | |
| C. | 若增大壓強,則物質Y的轉化率減小 | |
| D. | 若升高溫度,X的體積分數增大,則該反應的△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A中碳原子與氫原子的個數比是1:3,無法確定A中是否含有氧原子 | |
| B. | A的一種同分異構體的結構簡式:CH3OCH3 | |
| C. | A物質可以發生消去、取代、加成反應 | |
| D. | A與乙二酸可以通過縮聚反應生成高分子化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com