
【題目】NO2、O2和熔融NaNO3可制作燃料電池,其原理如圖。該電池在使用過程中石墨1電極上生成氧化物Y。下列說去錯誤的是

A. 若將該電池中的熔融NaNO3換成NaOH溶液,則不可能產生電流
B. 該電池放電時NO3-從右側向左側遷移
C. 石墨I電極的電極反應式為NO2+NO3--e-=N2O5
D. 相同條件下,放電過程中消耗的NO2和O2的體積比為4︰1
科目:高中化學 來源: 題型:
【題目】混合物分離和提純常用下圖裝置進行,按要求回答下列問題:

(1)儀器①的名稱__________。
(2)除去澄清石灰水中懸浮的CaCO3顆粒應選用_______(填字母,下同)。
(3)分離乙酸(沸點118℃)和乙酸乙酯(沸點77.1℃)的混合物應選用_______。
(4)用CCl4提取碘水中的碘單質應選用_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用0.2000 mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:
①用蒸餾水洗滌堿式滴定管,并注入NaOH溶液至“0”刻度線以上
②固定好滴定管并使滴定管尖嘴充滿液體
③調節液面至“0”或“0”刻度線稍下,并記下讀數
④量取20.00mL待測液注入潔凈的錐形瓶中,并加入3mL酚酞溶液
⑤用標準液滴定至終點,記下滴定管液面讀數

(1)以上步驟有錯誤的是(填編號)________。
(2)用標準NaOH溶液滴定時,應將標準NaOH溶液注入____中。(從圖中選填“甲”或“乙”)
(3)下列操作會引起實驗結果偏大的是:______(填編號)
A.在錐形瓶裝液前,留有少量蒸餾水
B.滴定前,滴定管尖嘴有氣泡,滴定后無氣泡
C.量取待測液的滴定管用蒸餾水洗滌后,未用待測液潤洗
D.裝標準溶液的滴定管滴定前仰視讀數,滴定后俯視讀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學課上,同學們利用下列實驗探究堿的化學性質:

(1)A實驗中觀察到的現象是_______。
(2)B實驗中發生的離子反應方程式是_____。
(3)C實驗中發生的離子反應方程式是____。
(4)實驗結束后,同學們將廢液倒入同一只廢液缸中,最后發現廢液渾濁并顯紅色。
(提出問題)廢液中含有什么物質?
(假設猜想)通過分析,同學們猜想:廢液中除酚酞、碳酸鈣及水以外一定含有_____。
老師問:廢液中還可能有什么物質?引發了同學們熱烈討論,下面是大家的發言:
學生甲 | 可能有CaCl2、Na2CO3 | 學生丙 | 可能有Ca(OH)2、CaCl2 |
學生乙 | 可能有NaOH、Na2CO3 | 學生丁 | 可能有Na2CO3 |
學生戊 | 可能有NaOH | … | … |
上述幾位學生的猜想中,有一種明顯不合理,你認為誰的猜想不合理?并說明理由。_____
(實驗驗證)同學們對可能含有的物質進行確定,取一定量的廢液過濾,向濾液中逐滴加入氯化鋇溶液,得到白色沉淀,紅色褪去。
(結論)上述廢液中,還含有____,沒有_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述在確的是
A. 等質量的CO與N2,質子數之比為1︰1
B. 標況下,相同體積的H2O和NH3含有的電子數相同
C. 1molO2分別與足量S、SO2反應,轉移的電子數相同
D. 2 mol/L NH4CI溶液與1mol/L(NH4)2SO4溶液中,NH4+數目相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅器久置于空氣中會和空氣中的水蒸氣、二氧化碳、氧氣作用產生“綠銹”,該“綠銹”俗稱“銅綠”,又稱“孔雀石”(堿式碳酸銅),“銅綠”能跟酸反應生成銅鹽、二氧化碳和水。某同學利用下述系列反應實現了“銅→銅綠→……→銅”的轉化。
銅![]() 銅綠
銅綠![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)從三種不同分類標準回答,“銅綠”屬于物質的類別是____。
(2)請寫出銅綠與鹽酸反應的化學方程式_____。
(3)寫出B的化學式_____。
(4)上述轉化過程中屬于化合反應的是___,屬于復分解反應的是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組為驗證常見還原劑SO2、I-、Fe2+的還原性強弱的順序為SO2>I->Fe2+,用下圖所示裝置進行實驗(加熱和夾持裝置已略,氣密性已檢驗)。
已知:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
MnCl2+Cl2↑+2H2O、Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
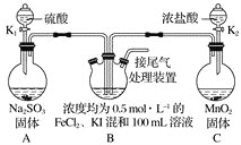

(1)上述實驗需要加熱的裝置是_____。
(2)D中燒杯盛放的是____。
(3)實驗開始時,關閉K1,打開K2,通入少量氯氣,寫出B中發生反應的離子方程式___。
①為驗證I-的還原性比Fe2+強,取(3)后B中的少量溶液于試管中,應再往試管中滴入___溶液,現象是____。
②在(3)后,為了比較SO2和I-的還原性強弱,接下來的操作是___。
A.關閉K2打開K1
B.關閉K1打開K2
C.同時打開K1和K2
(4)若打開K2,通入Cl2恰好將Fe2+、I-全部氧化后,再打開K1通入SO2,當Fe3+全部轉化為Fe2+時,此時通入的SO2的體積(標準狀況下)為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某粗鹽樣品含有Na2SO4、MgCl2、CaCl2等雜質。實驗室提純流程如下:
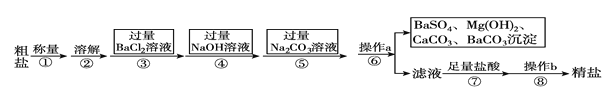
(1)操作a的名稱為________,在操作b中玻璃棒的作用是_____________________。
(2)進行步驟③后,判斷BaCl2過量的方法是______________________________(寫出步驟、現象)。
(3)步驟⑦中能用稀硫酸代替稀鹽酸嗎?________(填“能”或“不能”),原因是_____________。
(4)某氯化鉀樣品中含雜質硫酸鉀,為了除去硫酸鉀,要做以下實驗:
A.向濾液中滴加稀鹽酸,邊滴邊振蕩至不再產生氣體
B.將氯化鉀樣品溶于適量蒸餾水,配成溶液
C.過濾,將白色沉淀濾出
D.向溶液中加入過量碳酸鉀溶液,邊滴邊振蕩至不再產生白色沉淀
E.向溶液中加入過量氯化鋇溶液,邊滴邊振蕩至不再產生沉淀
F.將濾液蒸干,得到晶體
①正確的實驗操作順序為______________(填寫序號)。
②進行F操作時用到的儀器主要有____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.05mol/LNaOH溶液分別滴定10.00mL濃度均為0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲線如圖。下列說法正確的是

A. 對兩種弱酸滴定均可選用甲基橙作指示劑
B. ③處溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的電離程度:②>③>④
D. 點①和點②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com