
科目:高中化學 來源:2016-2017學年廣東省高一上期中化學卷(解析版) 題型:選擇題
下列實驗操作或設計中,可行的是( )
A. CO2通入足量BaCl2溶液中,產生白色沉淀
B. 除去O2中混有的H2,可將氣體通過灼熱CuO
C. 利用分液斗可分離酒精和氯化鈉的混合物
D. 加稀鹽酸后過濾,除去銅扮中沒有的少量鎂粉和鋁粉
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二12月月考化學卷(解析版) 題型:選擇題
有關乙烷、乙烯、乙炔、苯分子結構的比較錯誤的是( )
A.乙烷、乙烯、乙炔、苯中各原子均處于同一平面上
B.碳碳鍵長:乙烷>苯>乙烯>乙炔
C.碳碳鍵鍵能:乙炔>乙烯>苯>乙烷
D.鍵角:乙炔>乙烯═ 苯>乙烷
苯>乙烷
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一12月月考化學試卷(解析版) 題型:選擇題
化學在生產和日常生活中有著重要的應用,下列說法不正確的是
A. 氧化鋁用作耐火材料
氧化鋁用作耐火材料
B.Na2O常用于潛水艇或呼吸面具的供氧劑
C.硅酸鈉是制備木材防火劑的原料
D.FeCl3溶液可用于刻制印刷銅電路板
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一12月月考化學試卷(解析版) 題型:選擇題
下列有關金屬及其化合物的說法正確的是
A.室溫時,金屬鈉保存不當會變成Na2O2
B.Mg和Fe在一定條件下與水反應都生成氫氣和對應的堿
C.氧化鐵俗稱鐵紅常作紅色油漆和涂料
D.由于鋁在空氣中不會銹蝕,故鋁制品的使用壽命都很長
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南瀏陽一中等兩校高二12月聯考化學卷(解析版) 題型:填空題
某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)的分解反應。
(1)將一定量純凈的氨基甲酸銨固體置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
實驗測得不同溫度下的平衡數據列于下表 :
:
溫度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡總壓強/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡氣體 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①該可逆反應的平衡常數的表達式為________________________
②可以判斷該分解反應已經達到平衡的是________。
A.2v(NH3)=v(CO2)
B.密閉容器中混合氣體的密度不變
C.密閉容器中CO2的體積分數不變
D.密閉容器中總壓強不變
③取一定量的氨基甲酸銨固體放在一個帶活塞的密閉真空容器中,在25 ℃下達到分解平衡。若在恒溫下增大容器體積,氨基甲酸銨固體的質量將________(填“增加”、“減少”或“不變”)。
④該反應的焓變ΔH_________0(填“>”、“=”或“<”)
(2)在高溫下一氧化碳可將二氧化硫還原為單質硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
請寫出CO與SO2反應的熱化學方程式
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南瀏陽一中等兩校高二12月聯考化學卷(解析版) 題型:選擇題
為探究外界條件對反應:mA(g)+nB(g)?cZ(g )△H的影響,以A和B物質的量之比為m:n開始反應,通過實驗得到不同條件下達到平衡時Z的物質的量分數.實驗結果如圖所示,下列判斷正確的是( )
)△H的影響,以A和B物質的量之比為m:n開始反應,通過實驗得到不同條件下達到平衡時Z的物質的量分數.實驗結果如圖所示,下列判斷正確的是( )

A.△H>0
B.升溫,正、逆反應速率都增大,平衡常數減小
C.增大壓強,Z的含量減小
D.在恒溫恒容下,向已達到平衡的體系中加入少量Z,達到平衡后Z的含量減小
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江哈爾濱六中高一上期末化學卷(解析版) 題型:實驗題
Ⅰ、實驗室采用MgCl2、 AlCl3的混合溶液與過量氨水反應
AlCl3的混合溶液與過量氨水反應 制備MgAl2O4,主要流程如下:
制備MgAl2O4,主要流程如下:
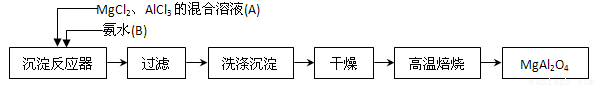
(1)寫出AlCl3與氨水反應的化學反應方程式_________________________。
(2)判斷流程中沉淀是否洗凈所用的試劑是 ,高溫焙燒時,用于盛放固體的儀器名稱是 。
Ⅱ、無水AlCl3(183 ℃升華)遇潮濕空氣即產生大量白霧,實驗室可用下列裝置制備。
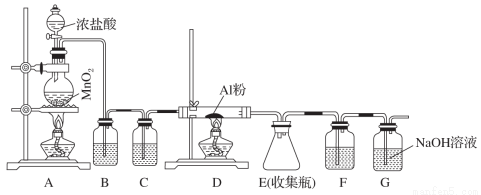
(3)其中裝置A用來制備氯氣,寫出其離子反應方程式:______________________。
(4)裝置B中盛放飽和NaCl溶液,該裝置的主要作用是__________________________。
(5)F中試劑是________。G為尾氣處 理裝置,其中反應的化學方程式:__________________。
理裝置,其中反應的化學方程式:__________________。
(6)制備氯氣的反應會因鹽酸濃度下降而停止。為測定反應殘余液中鹽酸的濃度,探究小組同學提出下列實驗方案:與足量AgNO3溶液反應,稱量生成的AgCl質量。此方案 (填“可行”,“不可行”),理由是_________________________。
查看答案和解析>>
科目:高中化學 來源:2017屆江西省高三上月考三化學試卷(解析版) 題型:填空題
研究大氣中含硫化合物和含碳化合物的轉化對環境保護具有重要意義。
(1)SO2的大量排放會引起嚴重的環境問題是 ,潮濕條件下,寫出大氣中SO2轉化為HSO3-的方程式 ;
(2)土壤中的微生物可將大氣中H2S經兩步反應氧化成SO42-,兩步反應的能量變化示意圖如下:
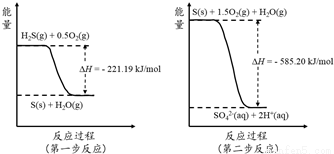
1mol H2S(g)全部氧化成SO42-(aq)的熱化學方程式為 ;
(3)SO2是工業制硫酸的原料之一,一定溫度下,向容積為2L的密閉容器中充入一定量的SO2和O2,發生反應:2SO2(g)+O2(g) 2SO3(g),過程中測定的部分數據見下表:
2SO3(g),過程中測定的部分數據見下表:
時間/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反應在0-4min內的平均速率為v(SO2)= ;
②此溫度下該反應的化學平衡常數K= ;
③8min時,維持溫度不變,向反應容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新達到平衡時混合氣體中SO2的百分含量將 (填“減小”、“增大”或“不變”)。
(4)科學家用氮化鎵材料與銅組裝如下圖的人工光合系統,利用該裝置成功地實現了以CO2和H2O合成CH4的反應。

寫出銅電極表面的電極反應式 ,為提高該人工光合系統的工作效率,可向裝置中加入少量 (填“鹽酸”或“硫酸”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com