
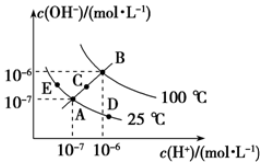
 已知水的電離平衡曲線如圖所示,
已知水的電離平衡曲線如圖所示,分析 (1)水的離子積常數只與溫度有關,溫度越高,離子積常數越大;
(2)從A點到D點c(H+)變大,c(OH-)變小,但Kw不變;
(3)E對應的溫度下,Kw=10-14,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則酸溶液中的n(H+)等于堿溶液中的n(OH-),據此計算;
(4)酸、堿都是強電解質,溶液呈中性說明氫離子和氫氧根離子的物質的量相等,結合水的離子積常數確定強酸的pH1與強堿的pH2之間應滿足的關系.
解答 解:(1)水的離子積常數只與溫度有關,溫度越高,離子積常數越大,同一曲線是相同溫度,根據圖知,溫度高低點順序是B>C>A=D=E,所以離子積常數大小順序是B>C>A=D=E,
故答案為:B>C>A=D=E;
(2)在A點時,c(H+)=c(OH-),溶液顯中性,而到D點c(H+)變大,c(OH-)變小,溶液顯酸性,即由A點到D點,溶液由中性變為酸性,但Kw不變.
a、升高溫度,Kw變大,故a錯誤;
b、加入少量鹽酸,則溶液顯酸性,氫離子濃度增大,氫氧根離子濃度減小,故b正確;
c、加入氯化銨,水解顯酸性,且Kw不變,故c正確.
故選bc,
故答案為:bc;
(3)E對應的溫度下,Kw=10-14,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則酸溶液中的n(H+)等于堿溶液中的n(OH-),故有:
10-5mol/L×V堿=10-4mol/L×V酸,解得:$\frac{{V}_{堿}}{{V}_{酸}}$=$\frac{10}{1}$,故答案為:10:1;
(4)要注意的是95°C時,水的離子積為10-12,即酸、堿濃度相等時pH(酸)+pH(堿)=12,現強堿的OH-濃度是強酸H+濃度的100倍,所以pH(酸)+pH(堿)=14,即pH1+pH2=14,或a+b=14,
故答案為:a+b=14(或pH1+pH2=14).
點評 本題考查酸堿混合的定性判斷和溶液PH的有關計算,題目難度中等,注意酸堿混合時酸堿物質的量的關系以及溶液PH與c(H+)、(OH-)的關系.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室需用480mL、0.1mol/L的CuSO4溶液,應選用500mL容量瓶,稱取12.5g膽礬 | |
| B. | 酸堿中和滴定實驗中,錐形瓶用蒸餾水洗凈后,需要用待測溶液潤洗2-3次 | |
| C. | 溶解固體溶質或稀釋溶液時,未冷卻至室溫即轉入容量瓶進行定容 | |
| D. | 用標準濃度的NaOH 溶液滴定未知濃度的稀鹽酸,堿式滴定管用蒸餾水潤洗后不需要用標準溶液潤洗2--3次 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器里P、Q、R、S四種物質共存 | |
| B. | 容器里氣體總物質的量不再改變 | |
| C. | 容器內氣體壓強、密度不隨時間變化 | |
| D. | 單位時間內生成nmol P同時生成nmol S |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單位時間內生成n mol X2,同時生成n mol XY | |
| B. | 單位時間內生成n mol X2,同時生成n mol Y2 | |
| C. | 單位時間內生成2n mol XY,同時生成n mol Y2 | |
| D. | 容器內總壓強不隨時間變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 7 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 糠醛(
糠醛(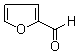 )可與新制含有NaOH的Cu(OH)2懸濁液在加熱條件下反應得到磚紅色沉淀Cu2O.
)可與新制含有NaOH的Cu(OH)2懸濁液在加熱條件下反應得到磚紅色沉淀Cu2O. 分子中含有σ鍵的數目為11mol.
分子中含有σ鍵的數目為11mol. 分子中碳原子軌道的雜化類型是sp2.
分子中碳原子軌道的雜化類型是sp2. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$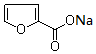 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O(g)→H2O(1)+44.0kJ | B. | 2HI(g)→H2(g)+I2(g)-9.4kJ | ||
| C. | 濃硫酸溶于水 | D. | 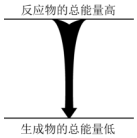 能量變化如圖所示的化學反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com