
| 時間 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
分析 (1)反應熱=反應物總鍵能-生成物總鍵能,根據2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1計算;
(2)①X、Y的起始濃度分別為0.2mol/L、0.6mol/L,前10min內,X濃度增大了0.4mol/L、Y的濃度減小0.2mol/L,由于NO2、N2O4與按物質的量2:1反應,則X為NO2、Y為N2O4;平衡常數K=$\frac{{C}^{2}(N{O}_{2})}{C({N}_{2}{O}_{4})}$,代入物質的濃度計算;
②根據v=$\frac{△c}{△t}$計算v(NO2);20min時,Y(N2O4)的濃度不變,X(NO2)的濃度增大,改變的條件應是增大NO2的濃度,等效為增大壓強,平衡向生成N2O4的向逆反應進行,減少2molNO2的同時混合氣體總物質的量減小1mol,則混合氣體中NO2的百分含量減小;
(3)肼易溶于水,它是與氨類似的弱堿,則電離生成OH-和陽離子;肼-空氣燃料電池放電時,負極上肼失電子和氫氧根離子反應生成H2O和氮氣,正極上氧氣得電子和水反應生成氫氧根離子;
(4)若將0.2mo1•L-1N2H4•H2O溶液與0.1mol•L-1HCl溶液等體積混合,得到物質的濃度相等N2H5C1和N2H4•H2O,而在相同條件下N2H4•H2O的電離程度大于N2H5C1的水解程度,所以離子濃度大小為:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),由此解答.
解答 解:(1)設1mol N2O4(1)完全分解成相應的原子時需要吸收的能量QKJ,2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1,則:
193kJ/mol×2+391kJ/mol×8+QkJ/mol-946kJ/mol×3-463kJ/mol×8=-1225 kJ/mol,解得Q=1803,
故答案為:1803kJ;
(2)①化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值,X、Y的起始濃度分別為0.2mol/L、0.6mol/L,10min時到達平衡,X濃度增大了0.4mol/L、Y的濃度減小0.2mol/L,由于NO2、N2O4與按物質的量2:1反應,則X為NO2、Y為N2O4,平衡常數K=$\frac{{C}^{2}(N{O}_{2})}{C({N}_{2}{O}_{4})}$=$\frac{0.{6}^{2}}{0.4}$=0.9,
故答案為:NO2;0.9;
②v(NO2)=$\frac{0.6mol/L-0.2mol/L}{10min}$=0.04mol/(L•min);20min時,Y(N2O4)的濃度不變,X(NO2)的濃度增大,改變的條件應是增大NO2的濃度(或向容器中加入0.8mol二氧化氮),等效為增大壓強,平衡向生成N2O4的向逆反應進行,減少2molNO2的同時混合氣體總物質的量減小1mol,則混合氣體中NO2的百分含量減小,
故答案為:0.04mol/(L•min);增大NO2的濃度(或向容器中加入0.8mol二氧化氮);B;
(3)肼易溶于水,它是與氨類似的弱堿,則電離生成OH-和陽離子,電離方程式為N2H4+H2O?N2H+5+OH-,肼-空氣燃料電池放電時,負極上肼失電子和氫氧根離子反應生成H2O和氮氣,電極反應式為N2H4+4OH--4e-=4H2O+N2,正極上氧氣得電子和水反應生成氫氧根離子,電極反應式為O2+2H2O+4e-=4OH-,
故答案為:N2H4+H2O?N2H+5+OH-;N2H4+4OH--4e-=4H2O+N2;
(4)若將0.2mo1•L-1N2H4•H2O溶液與0.1mol•L-1HCl溶液等體積混合,得到物質的濃度相等N2H5C1和N2H4•H2O,而在相同條件下N2H4•H2O的電離程度大于N2H5C1的水解程度,所以離子濃度大小為:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),
故答案為:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
點評 本題考查反應熱的計算、化學平衡常數的計算、化學平衡影響移動、電化學知識、溶液中離子濃度的比較等,是對學生綜合能力的考查,電極反應式的書寫,明確各個電極上發生的反應是解答關鍵,離子濃度大小比較注意相同條件下N2H4•H2O的電離程度大于N2H5C1的水解程度,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 甲乙丙丁戊是中學常見的無機物,他們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法錯誤的是( )
甲乙丙丁戊是中學常見的無機物,他們的轉化關系如圖所示(某些條件和部分產物已略去).下列說法錯誤的是( )| A. | 若戊為一種強堿且焰色反應為黃色,則上述反應可能都屬于氧化還原反應 | |
| B. | 常溫下,若丙為無色氣體,戊為紅棕色氣體,則甲、乙一定是銅和稀硝酸 | |
| C. | 若甲為硫磺燃燒產物,丁為水,則戊可用于干燥甲 | |
| D. | 若甲為濃鹽酸,乙為MnO2,則戊可能使品紅褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 麻黃素中含氧官能團的名稱是羥基,屬于醇類(填“醇”或“酚”).
麻黃素中含氧官能團的名稱是羥基,屬于醇類(填“醇”或“酚”).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
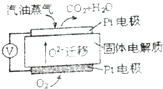
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化工工業中常用乙苯脫氫的方法制備苯乙烯.
化工工業中常用乙苯脫氫的方法制備苯乙烯.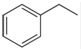 (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol查看答案和解析>>
科目:高中化學 來源: 題型:解答題
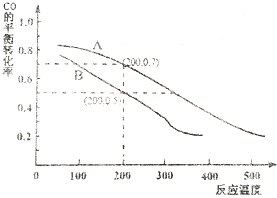
 2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.
2013年霧霾天氣多次肆虐我國中東部地區.其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一.| 溫度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com