
| A. | 四種元素的原子半徑由小到大的順序為:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成離子化合物,又能形成共價化合物 | |
| C. | X與其余三種元素之間形成的核外電子總數為10的微粒只有2種 | |
| D. | H2Z的熔點比H2W高,是因為它們的晶體類型不同 |
分析 X、Y、Z和W代表原子序數依次增大的四種短周期主族元素,在元素周期表中,Z與Y、W均相鄰,Y、Z、W三種元素的原子最外層電子數之和為17,若Y、Z、W三者處于同一周期或同一主族,最外層電子數之和不可能為17,處于不同周期的Y、Z、W兩兩相鄰,可能出現的位置關系有: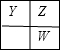 、
、 ,設Y的最外層電子數為x,若為第一種情況,則有x+x+1+x+1=17,解得x=5,Y、Z、W對應的三種元素分別為N,O,S;若為第二種情況,則有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分別位于不同周期,則X為H元素,據此解答.
,設Y的最外層電子數為x,若為第一種情況,則有x+x+1+x+1=17,解得x=5,Y、Z、W對應的三種元素分別為N,O,S;若為第二種情況,則有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分別位于不同周期,則X為H元素,據此解答.
解答 解:X、Y、Z和W代表原子序數依次增大的四種短周期主族元素,在元素周期表中,Z與Y、W均相鄰,Y、Z、W三種元素的原子最外層電子數之和為17,若Y、Z、W三者處于同一周期或同一主族,最外層電子數之和不可能為17,處于不同周期的Y、Z、W兩兩相鄰,可能出現的位置關系有: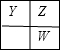 、
、 ,設Y的最外層電子數為x,若為第一種情況,則有x+x+1+x+1=17,解得x=5,Y、Z、W對應的三種元素分別為N,O,S;若為第二種情況,則有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分別位于不同周期,則X為H元素.
,設Y的最外層電子數為x,若為第一種情況,則有x+x+1+x+1=17,解得x=5,Y、Z、W對應的三種元素分別為N,O,S;若為第二種情況,則有x+x+x+1=17,解得x=$\frac{16}{3}$,不合理,且X、Y、W分別位于不同周期,則X為H元素.
A.所有元素中H原子半徑最小,同周期元素從左到右原子半徑逐漸減小,一般電子層越多原子半徑越大,故原子半徑:r(X)<r(Z)<r(Y)<r(W),故A錯誤;
B.X、Y、Z可形成的化合物可為HNO3或NH4NO3等,前者為共價化合物,后者為離子化合物,故B正確;
C.H與其余三種元素之間形成的核外電子總數為10的微粒有NH3、NH4+、OH-、H2O、H3O+等,故C錯誤;
D.H2O、H2S都形成分子晶體,但H2O分子之間存在氫鍵,其沸點比H2S高,故D錯誤,
故選B.
點評 本題考查結構性質位置關系應用,注意把握原子結構特點以及元素在周期表中的位置,側重于學生的分析能力的考查,為高考常見題型,難度不大.


 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案科目:高中化學 來源: 題型:選擇題
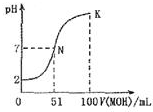 常溫下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況體積變化忽略不計).下列說法中不正確的是
常溫下,向100mL0.01mol•L-1 HA溶液中逐滴加入0.02mol-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況體積變化忽略不計).下列說法中不正確的是| A. | MOH為一元弱堿 | |
| B. | MA 稀溶液PH<7 | |
| C. | N點水的電離程度大于K點水的電離程度 | |
| D. | K點對應的溶液的PH=10,則C(MOH)+C(OH)-C(H+=0.01mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 鈉硫電池以熔融金屬鈉、熔融硫和多硫化鈉(Na2Sx)分別作為兩個電極的反應物,固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示:
鈉硫電池以熔融金屬鈉、熔融硫和多硫化鈉(Na2Sx)分別作為兩個電極的反應物,固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示:| 物質 | Na | S | Al2O3 |
| 熔點/℃ | 97.8 | 115 | 2050 |
| 沸點/℃ | 892 | 444.6 | 2980 |
| A. | 放電時,電極A為負極 | |
| B. | 根據上表數據,請你判斷該電池工作的適宜溫度應控制在350℃~2050℃ | |
| C. | 放電時,Na+的移動方向為從電極A到電極B | |
| D. | 充電時,總反應為Na2Sx═2Na+xS(3<x<5),則陽極的電極反應式為Sx2--2e-═xS |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
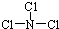 ,X 與水反應的化學方程式是NCl3+3H2O═NH3+3HClO.
,X 與水反應的化學方程式是NCl3+3H2O═NH3+3HClO.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
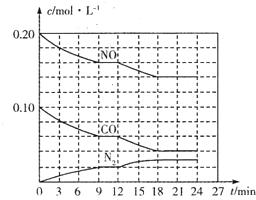 為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.
為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉鉀合金可用作快中子反應堆導熱劑的原因之一是常溫下呈液態 | |
| B. | 我國航天員穿的航天服使用的高強度、高韌性的特種尼龍,是一種有機高分子合成材料 | |
| C. | 硅主要以單質、氧化物、硅酸鹽的形式存在于自然界中 | |
| D. | 用氫作汽車燃料,用燃料電池作動力,合成可再生的儲氫材料,可以實現汽車的“零排放” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④ | B. | ③⑥ | C. | ①③ | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com