
【題目】現有20mL濃度為0.04mol·L-1的Na2SO3溶液恰好與10mL濃度為0.02mol·L-1的K2A2O7溶液完全反應。已知Na2SO3可被K2A2O7氧化為Na2SO4,則元素A在還原產物中的化合價為( )
A.+2B.+3C.+4D.+5
科目:高中化學 來源: 題型:
【題目】一定條件下,反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密閉容器中進行,10 s時,水蒸氣的物質的量增加了0.60 mol。則下列說法不正確的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密閉容器中進行,10 s時,水蒸氣的物質的量增加了0.60 mol。則下列說法不正確的是( )
A. 10 s內,NH3的平均反應速率為0.008 mol·L-1·s-1
B. 該反應達到平衡時6v正(O2)=5v逆(H2O)
C. 10 s內,反應放出的熱量為0.1a kJ
D. 10 s時,H2O的反應速率為0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2C2O4是二元弱酸,室溫下向某濃度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的組成百分率與pH的關系如圖所示,下列說法正確的是
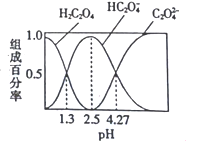
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反應HC2O4-+H2O![]() H2C2O4+OH-的平衡常數為10-4.27
H2C2O4+OH-的平衡常數為10-4.27
C. 向溶液中加入KOH溶液將pH由1.3調至4.27的過程中水的電離程度先增大后減小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰基烯酸酯在堿性條件下能快速聚合為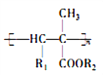 ,從而具有膠黏性,某種氰基丙烯酸酯(H)的合成路線如下:
,從而具有膠黏性,某種氰基丙烯酸酯(H)的合成路線如下:
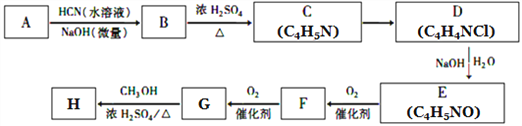
已知:①A的相對分子量為58,氧元素質量分數為0. 276,核磁共振氫譜顯示為單峰;
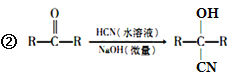
回答下列問題:
(1)A的化學名稱為____________。
(2)C的結構簡式為________________,F中的含氧官能團名稱是________________。
(3)由E生成F的反應類型為_____________,由G生成H的反應類型為_____________。
(4)由G生成H的化學方程式為________________________________。
(5)寫出A的能夠發(fā)生銀鏡反應的同分異構體的結構簡式______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁鎂合金已成為飛機制造、化工生產等行業(yè)的重要材料.某研究性學習小組的同學,為測定某含鎂3%~5%的鋁鎂合金(不含其他元素)中鎂的質量分數,設計下列實驗方案進行探究。填寫下列空白。
[實驗方案]
將鋁鎂合金與足量稀硫酸溶液反應,測定生成氣體在通常狀況下(約20℃,1.01×105 Pa)的體積。
[問題討論]
(1)同學們擬選用下列實驗裝置完成實驗:

①你認為最簡易的裝置其連接順序是:
A接(____)( )接( )( )接( )( )。(填接口字母,可不填滿)
②實驗開始時,先打開分液漏斗上口的玻璃塞,再輕輕打開其活塞,一會兒后稀硫酸也不能順利滴入錐形瓶.請你幫助分析原因_______________________________。
(2)仔細分析實驗裝置后,同學們經討論認為以下兩點會引起較大誤差:稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小。于是他們設計了如圖所示的實驗裝置。

(堿式滴定管上的刻度數值上小下大)
①裝置中導管a的作用是____________________________________________________。
②實驗前后堿式滴定管中液面讀數分別為V1 mL、V2 mL.則產生氫氣的體積為________ mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烯烴與H2發(fā)生加成反應后得到的產物是CH3CH(CH3)2.
(1)該產物的系統(tǒng)命名的名稱為______,寫出該產物的同分異構體的結構簡式______
(2)光照條件下,該產物與氯氣反應,生成含兩個甲基的一氯代物,寫出反應的化學方程式______________________ ,反應類型是______________
(3)原來烯烴的結構簡式為:______,系統(tǒng)命名的名稱為______________
(4)寫出該烯烴一定條件下發(fā)生加聚反應的方程式:_____________;
(5)寫出原來的烯烴使溴的四氯化碳溶液褪色的化學反應方程式:____; 反應類型是__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組對中學課本中可生成氫氣的反應進行了研究,總結出兩個可以生成H2的反應:①Zn+鹽酸;②Na+水。為點燃經驗純后上述兩個反應生成的H2,他們設計了圖示裝置。請回答下列問題:

(1)寫出Na與H2O反應的化學方程式:__。
(2)實驗小組在點燃用上述裝置制得的H2時,實驗①獲得成功,實驗②卻失敗了。他們分析認為失敗的原因是Na與H2O的反應速率太快,Na的用量太少。于是他們準備增加鈉的用量,可老師說太危險,你認為產生危險的原因是__。
(3)實驗小組查閱資料知鈉、煤油、水的密度分別為0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并據此對實驗進行改進,在改進后的實驗中H2的生成速率減慢,原因是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是( )
A. KOH的摩爾質量是56g
B. 一個二氧化碳分子的質量就是其相對分子質量
C. 硫原子的摩爾質量就是硫的相對原子質量
D. 氦氣的摩爾質量以克每摩爾為單位時在數值上等于它的相對原子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了從KCl和MnO2的混合物中回收MnO2,下列操作順序正確的是(已知MnO2為黑色難溶于水的固體)( )
A.溶解 過濾 蒸發(fā) 洗滌B.溶解 過濾 洗滌 干燥
C.溶解 過濾 蒸發(fā) 干燥D.溶解 洗滌 過濾 干燥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com