
分析 鹽酸是一元強酸、硫酸是二元強酸,醋酸是一元弱酸,
(1)若物質的量濃度均為0.1mol•L-1,a、b、c中c(H+)大小順序是b>a>c,c(H+)越大溶液的pH越小;
(2)若三種酸的pH相同,說明三種酸中c(H+)相同,酸的電離程度越大、酸的元數越大,酸的濃度越小;
(3)在同體積、同濃度的三種酸中,三種酸的物質的量相同,分別加入等濃度的NaOH溶液,消耗NaOH溶液體積與酸最終電離出的n(H+)成正比;
(4)同體積、同pH的三種酸中,最終電離出的n(H+)大小順序是c>a=b,分別加入等濃度的NaOH溶液,則恰好中和時所消耗的NaOH溶液的體積與最終電離出的n(H+)成正比;
(5)在同體積、同濃度的三種酸中,最終電離出的n(H+)大小順序是b>a=c,分別加入足量的鋅(Zn)充分反應后,在相同條件下產生H2的體積與最終電離出的n(H+)成正比;
(6)在同體積、同pH的三種酸中,最終電離出的n(H+)大小順序是a=b<c,分別加入足量的鋅(Zn)充分反應后,在相同條件下產生H2的體積與最終電離出的n(H+)成正比.
解答 解:鹽酸是一元強酸、硫酸是二元強酸,醋酸是一元弱酸,
(1)若物質的量濃度均為0.1mol•L-1,a、b、c中c(H+)大小順序是b>a>c,c(H+)越大溶液的pH越小,則溶液pH大小順序是c>a>b,故答案為:c>a>b;
(2)若三種酸的pH相同,說明三種酸中c(H+)相同,酸的電離程度越大、酸的元數越大,酸的濃度越小,則三種酸的濃度大小順序是c>a>b,故答案為:c>a>b;
(3)在同體積、同濃度的三種酸中,三種酸的物質的量相同,最終電離出的n(H+)大小順序是b>a=c,分別加入等濃度的NaOH溶液,消耗NaOH溶液體積與酸最終電離出的n(H+)成正比,所以消耗NaOH溶液體積大小順序是b>a=c,故答案為:b>a=c;
(4)同體積、同pH的三種酸中,最終電離出的n(H+)大小順序是c>a=b,分別加入等濃度的NaOH溶液,則恰好中和時所消耗的NaOH溶液的體積與最終電離出的n(H+)成正比,則消耗NaOH溶液體積大小順序是c>a=b,故答案為:c>a=b;
(5)在同體積、同濃度的三種酸中,最終電離出的n(H+)大小順序是b>a=c,分別加入足量的鋅(Zn)充分反應后,在相同條件下產生H2的體積與最終電離出的n(H+)成正比,則最終生成氫氣體積大小順序是b>a=c,
故答案為:b>a=c;
(6)在同體積、同pH的三種酸中,最終電離出的n(H+)大小順序是a=b<c,分別加入足量的鋅(Zn)充分反應后,在相同條件下產生H2的體積與最終電離出的n(H+)成正比,則生成氫氣體積大小順序是a=b<c,
故答案為:a=b<c.
點評 本題考查弱電解質的電離,為高頻考點,側重考查學生比較、分析、判斷能力,明確弱酸溶液濃度與pH的關系是解本題關鍵,題目難點中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液時,分液漏斗的上層液體應由上口到出 | |
| B. | 向某溶液中加入稀鹽酸,產生的氣體通入澄清石灰水,石灰水變渾濁,該溶液一定是碳酸鹽溶液 | |
| C. | 配置0.1000mol•L-1氫氧化鈉溶液時,將液體轉移到容量瓶中需用玻璃棒引流 | |
| D. | 錐形瓶用作反應容器時可以加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
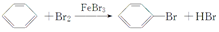 ,
,查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com