
【題目】高鐵酸鉀(K2FeO4)是一種高效凈水劑。已知:K2FeO4易溶于水,微溶于濃KOH溶液;在酸性或中性溶液中不穩定,在0~5℃的強堿性溶液中較穩定。某實驗小組欲制備高鐵酸鉀并測定其純度。
Ⅰ.制備高鐵酸鉀(夾持裝置略)
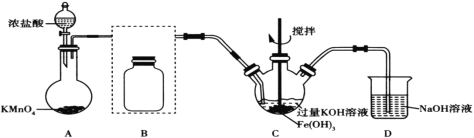
(1)裝置A為氯氣發生裝置,其中盛放高錳酸鉀的儀器名稱為__。
(2)將除雜裝置B補充完整并標明所用試劑__。
(3)裝置C中Cl2與Fe(OH)3、KOH反應生成K2FeO4的化學方程式是____。
(4)實驗時將裝置C置于冰水浴中,其原因是____。
(5)實驗后經結晶法得到的K2FeO4晶體仍含較多雜質,要得到更純的晶體,還應采取的操作方法是____。
Ⅱ.測定產品純度
(6)將wg K2FeO4粗產品溶于過量的堿性亞鉻酸鹽溶液中,充分反應后,加入稀硫酸酸化至pH為2,在所得的重鉻酸鹽溶液中加入5滴二苯胺磺酸鈉溶液作指示劑,然后用c mol·L1(NH4)2Fe(SO4)2標準溶液滴定至終點,消耗標準溶液VmL。已知該過程中涉及的離子反應主要有三個:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
該粗產品中K2FeO4的質量分數為__(用含w、c、V的代數式表示)。若滴定管沒有用標準液潤洗,則測得的結果__(填“偏高”“偏低”或“無影響”)。
【答案】圓底燒瓶  3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O K2FeO4在0~5℃環境中較穩定,防止副反應發生 重結晶 2CrO42-+2H+
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O K2FeO4在0~5℃環境中較穩定,防止副反應發生 重結晶 2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O ![]() 或
或![]() 或
或![]() 偏高
偏高
【解析】
Ⅰ利用濃鹽酸和KMnO4制備Cl2,制備的Cl2常含有HCl,需要用飽和食鹽水除雜,Cl2、Fe(OH)3和KOH反應生成K2FeO4,利用NaOH溶液處理多余的Cl2。
(1)根據儀器的結構,可知該儀器為圓底燒瓶;
(2)裝置B的作用是除去Cl2中的HCl,選用飽和食鹽水,裝置如圖所示 ;
;
(3)Cl2中Cl的化合價降低,從0降低到-1,共降低2價,Fe(OH)3中Fe的化合價升高,從+3升高到+6,化合價升降守恒,則Cl2和Fe(OH)3的系數比為3:2,再根據原子守恒配平,化學方程式為3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O;
(4)產物K2FeO4在0~5℃的強堿性溶液中較穩定,因此將裝置C置于冰水浴中是K2FeO4在0~5℃環境中較穩定,防止副反應發生;
(5)K2FeO4易溶于水中,結晶后的K2FeO4中含有較多雜質,可以利用重結晶提純;
Ⅱ(6)根據反應①和③,加入H2SO4酸化后,反應①中的產物CrO42-轉化為Cr2O72-,離子方程為2CrO42-+2H+Cr2O72-+H2O;
根據反應方程式,可得關系式K2FeO4~CrO42-~![]() Cr2O72-~3Fe2+,n(K2FeO4)=
Cr2O72-~3Fe2+,n(K2FeO4)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ×cV×10-3mol,m(K2FeO4)=
×cV×10-3mol,m(K2FeO4)=![]() ×cV×10-3mol×198g·mol-1=0.066cVg,則K2FeO4的質量分數為
×cV×10-3mol×198g·mol-1=0.066cVg,則K2FeO4的質量分數為![]() ;
;
如果滴定管沒有用標準液潤洗,那么消耗的標準液的體積會增加,計算得到K2FeO4的質量會增加,質量分數偏高。


科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.常溫下,將![]() 的醋酸溶液稀釋到原體積的10倍后,溶液的
的醋酸溶液稀釋到原體積的10倍后,溶液的![]()
B.常溫下,若NaHA溶液的![]() ,則
,則![]() 是弱酸
是弱酸
C.用鹽酸標準溶液滴定氨水至中性時,![]() 未被完全中和
未被完全中和
D.![]() 時
時![]() 溶液的
溶液的![]() 大于
大于![]() 時NaCl溶液的
時NaCl溶液的![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)現有以下物質:①NaCl晶體 ②液態HCl ③CaCO3固體 ④熔融KCl ⑤蔗糖 ⑥銅 ⑦CO2 ⑧H2SO4 ⑨KOH固體
a. 以上物質中能導電的是________________________________。
b. 以上物質中屬于電解質的是_______________________,屬于非電解質的是_______________________。
c. 以上物質中,溶于水且能導電的物質是_______________________。
(2)膠體和溶液的本質區別是________________,鑒別膠體和溶液所采用的方法是觀察是否能發生___________效應。
(3)下列3個反應,按要求填寫相關量。
①2Na2O2+2H2O=4NaOH+ O2↑反應中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的熱分解反應中,每消耗168 g NaHCO3,標準狀況下生成_____L CO2。
③Cl2+H2O=HCl+HClO反應中,標準狀況下每消耗22.4LCl2,轉移_____mol電子。
(4)在一個密閉容器中放入以下四種物質,在一定條件下發生化學反應,一段時間后,測得有關數據如下:
物質 | M | N | Q | P |
反應前質量(g) | 50 | 1 | 3 | 12 |
反應后質量(g) | x | 26 | 3 | 30 |
①該變化的基本反應類型是_____反應;
②物質Q在反應中起的作用是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學設計了如圖所示的裝置,完成下列問題:
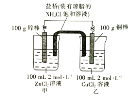
(1)反應過程中,______棒質量增加。
(2)總反應的離子方程式為_____。
(3)反應中,當其中一個電極質量變為102g時,另一電極質量______________(填大于、小于或等于)98g。
(4)反應過程中,鹽橋中的________ 離子進入甲杯。
(5)當外電路中轉移0.2mol電子時,乙燒杯中濃度最大的陽離子是_________,其物質的量濃度為_______________。(假設溶液體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)12.4 g Na2R含Na+0.4 mol,則Na2R的摩爾質量為________,R的相對原子質量為________。含R的質量為1.6 g的Na2R,其物質的量為________。
(2)86.4gA單質與4.80molCl2完全反應,生成3.20molAClx,則x=___________,A的摩爾質量為__________________g·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A是一種常見的一種金屬,F是一種紅褐色的沉淀。試根據圖中轉化關系,回答下列問題。
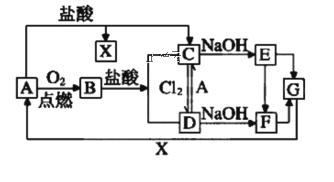
(1)寫出A、B、D、E的化學式:A___、B___、D___、E___。
(2)檢驗D中陽離子的方法:___。
(3)保存C溶液時為什么加固體A___。
(4)寫出下列轉化的離子方程式
①C→E___。
②A→C___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H3AsO3是一種劇毒物,可加入祛毒劑SnCl2來除去,反應方程式為:2H3AsO3+3SnCl2+12X=2As↓+3H2SnCl6+6H2O。下列關于該反應的說法中正確的是( )
A.還原劑是H3AsO3
B.X的化學式為HCl,是該反應的氧化劑
C.每生成0.2molAs,還原劑得到0.6mol電子
D.該反應轉移2mol電子,則消耗祛毒劑SnCl2為1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按要求作答:
(1)請根據官能團的不同對下列有機物進行分類:
① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]()
Ⅰ.酚:________酮:________醛:________(填序號);
Ⅱ.④的官能團的名稱為______、⑦的官能團的名稱為______;
(2)分子式為C4H8且屬于烯烴的有機物的同分異構體(不考慮順反異構)有 ____種; 高聚物的單體的結構簡式是_________。
高聚物的單體的結構簡式是_________。
(3)![]() 的名稱為:_____________;寫出
的名稱為:_____________;寫出![]() 聚合生成高分子化合物的化學方程式__________________________________;
聚合生成高分子化合物的化學方程式__________________________________;
(4)鍵線式![]() 表示的分子式為___________;與其互為同分異構體且一氯代物有兩種的烴的結構簡式____________________;
表示的分子式為___________;與其互為同分異構體且一氯代物有兩種的烴的結構簡式____________________;
(5)籃烷分子的結構如圖所示:
![]()
①籃烷的分子式為:________,其一氯代物有______種;
②若使1mol該烴的所有氫原子全部被氯原子取代,需要_____mol氯氣。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PbCrO4是一種黃色顏料,制備PbCrO4的一種實驗步驟如圖1:
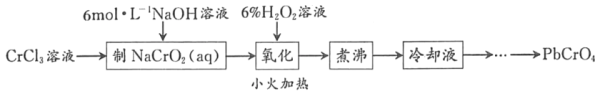
已知:①Cr(OH)3(兩性氫氧化物)呈綠色且難溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp為2.8×10﹣13,Pb(OH)2開始沉淀時pH為7.2,完全沉淀時pH為8.7。
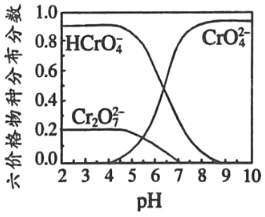
③六價鉻在溶液中物種分布分數與pH關系如圖2所示。
④PbCrO4可由沸騰的鉻酸鹽溶液與鉛鹽溶液作用制得,含PbCrO4晶種時更易生成
(1)實驗時需要配置100mL3molL﹣1CrCl3溶液,現有量筒、玻璃棒、燒杯,還需要玻璃儀器是___。
(2)“制NaCrO2(aq)”時,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”時H2O2滴加速度不宜過快,其原因是_____;“氧化”時發生反應的離子方程式為___。
(4)“煮沸”的目的是_____。
(5)請設計用“冷卻液”制備PbCrO4的實驗操作:_____[實驗中須使用的試劑有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 試紙]。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com