
| A. | 向FeBr2溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| B. | 除去MgCl2溶液中少量的FeCl3:3Mg+2Fe3+═2Fe+3Mg2+ | |
| C. | 向含有氨水的BaCl2溶液中通入SO2:SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O | |
| D. | 將少量二氧化碳通入氯化鈣溶液中:Ca2++CO2+H2O═CaCO3+2H+ |
分析 A.通入少量Cl2,只氧化亞鐵離子;
B.除去MgCl2溶液中少量的FeCl3,應加MgO或氫氧化鎂等促進鐵離子的水解;
C.反應生成亞硫酸鋇、氯化銨和水;
D.少量二氧化碳通入氯化鈣溶液不反應.
解答 解:A.亞鐵離子還原性大于溴離子,向溶液中通入少量,氯氣先氧化亞鐵離子,向FeBr2溶液中通入少量Cl2的離子反應為Cl2+2Fe2+═2Cl-+2Fe3+,故A錯誤;
B.鎂不能從氯化鐵溶液中置換出鐵單質,應加MgO或氫氧化鎂等促進鐵離子的水解,故B錯誤;
C.向含有氨水的BaCl2溶液中通入SO2時,SO2首先與NH3•H2O反應生成(NH4)2SO3,生成的再與Ba2+反應生成BaSO3沉淀,離子反應為SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O,故C正確;
D.碳酸酸性小于鹽酸,二氧化碳不能與氯化鈣溶液反應生成碳酸鈣和鹽酸,故D錯誤;
故選C.
點評 本題考查離子反應方程式書寫的正誤判斷,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重對氧化還原反應規律、鹽的水解、強酸制弱酸反應規律的理解的考查,注意離子反應中保留化學式的物質及電子、電荷守恒,題目難度不大.


 特高級教師點撥系列答案
特高級教師點撥系列答案科目:高中化學 來源: 題型:解答題
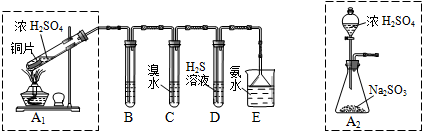
| 實驗操作 | 預期現象與結論 |
| 步驟1:取適量“吸收液”于小燒杯中,用膠頭滴管取l mol/L BaCl2溶液向小燒杯滴加直至過量. | 若出現白色渾濁,則溶液中存在SO32-或 SO42-. |
| 步驟2:將小燒杯中的濁液過濾、洗滌,再用適量水把附在濾紙上的固體沖入另一小燒杯中;向沖下的固體滴入1滴品紅,再滴入過量2 mol/L鹽酸,振蕩 用試管取適量濾液,向其中滴入過量l mol/LBa(OH)2溶液(或1滴品紅,再滴入2-3滴2 mol/L鹽酸),振蕩. 步驟3: | 若品紅褪色(或有氣泡)則存在SO32- 若出現白色沉淀(或品紅褪色或有氣泡),則存在HSO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L lmol•L-1 FeBr2溶液與lmol氯氣反應時轉移的電子數為3NA | |
| B. | 0.5 mol•L-1硫酸鈉溶液中含有溶質離子總數為1.5NA | |
| C. | 1mol硫酸氫鈉固體中含陽離子總數NA | |
| D. | 28g由乙烯和聚乙烯組成的混合氣體中含有碳碳雙鍵數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,H的化學式為KHCO3;
,H的化學式為KHCO3;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Si有良好的半導體性能,可直接用于制備光導纖維 | |
| B. | 淀粉、纖維素、蛋白質、油脂都是天然高分子化合物 | |
| C. | 用食醋可除去熱水壺內壁的水垢 | |
| D. | Cu的金屬活潑性比Fe弱,故水庫鐵閘門上接裝銅塊可減緩鐵腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀硫酸中加入銅粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蝕銅制印刷電路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氫氧化鈉溶液中通入過量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸鋁溶液中加入過量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2CO3?H++HCO3-; HCO3-?H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | NaHS═Na++H++S2- | D. | CH3COOH?H++CH3COO- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;
; ;
; CH2CH2OOCH、
CH2CH2OOCH、 COOCH2CH3、
COOCH2CH3、 CH2COOCH3、
CH2COOCH3、 00CCH2CH3.
00CCH2CH3. CH(CH3)OOCH.
CH(CH3)OOCH.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com